
题目列表(包括答案和解析)
(7分)反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
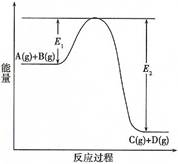
① 图中E1代表的意义是 。
该反应是 反应(填“吸热”、“放热”)。反应热△H的表达式为 。
② 当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”或“不变”)。
③ 在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2 (填“增大”、“减小”或“不变”)。化学平衡 移动(填“向左”、“向右”或“不”)。
(7分)反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
① 图中E1代表的意义是 。
该反应是 反应(填“吸热”、“放热”)。反应热△H的表达式为 。
② 当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”或“不变”)。
③ 在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2 (填“增大”、“减小”或“不变”)。化学平衡 移动(填“向左”、“向右”或“不”)。
(7分)反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。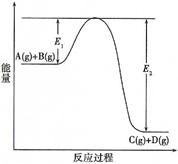
① 图中E1代表的意义是 。
该反应是 反应(填“吸热”、“放热”)。反应热△H的表达式为 。
② 当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”或“不变”)。
③ 在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2 (填“增大”、“减小”或“不变”)。化学平衡 移动(填“向左”、“向右”或“不”)。
 C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH= kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH= kJ/mol(用含有E1、E2代数式表示)。
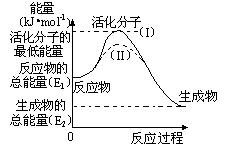
② 已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为 kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com