
题目列表(包括答案和解析)

| ||
| ||
甲、乙两烧杯中各盛有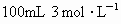 的盐酸和氢氧化钠,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2则加入的铝粉质量为
的盐酸和氢氧化钠,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2则加入的铝粉质量为
[ ]
|
A.5.4g |
B.3.6g |
|
C.2.7g |
D.1.8g |
甲、乙两烧杯中分别盛有100mL 3.0mol·L—1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体体积比:甲∶乙=1∶2,则加入铝粉的质量为
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
一、选择题(50分)
1~5:BBACA w.w.w.k.s.5 u.c.o.m 6~10:DBBDC 11~15:CDCCB 16~20:ADBCC 21~25:DDBAB
二、简答题(20分)
26、(1)2Na+2H2O=2NaOH +H2
(2)2Al+2NaOH+2H2O = 2NaAlO2 +3 H2
27.①C ②D ③AB ④BE ⑤BD
 (2)① 取少量蒸馏水,向其中加入少量试样,能放出大量热的则为浓硫酸,应之为稀硫酸。②观察状态,浓H2SO4为粘稠液体,而稀硫酸为粘稠度较小的液体。③比较相同体积的酸的样品质量大小,浓硫酸质量较大,而稀硫酸则密度小。④取少量试样,向其中投入铁片,若产生大量气体的则为稀硫酸,若无明显现象(钝化),则为浓硫酸。⑤用玻璃棒蘸取试样在白纸上写字,立即变黑的为浓硫酸,反之则为稀硫酸。⑥取少量试样,分别投入一小块铜片,稍加热发生反应的为浓硫酸,无现象的为稀硫酸。(3)SO2和H2。浓硫酸与锌反应放出SO2气体,随着反应的进行浓硫酸变为稀硫酸,锌与稀硫酸反应放出H2。
(2)① 取少量蒸馏水,向其中加入少量试样,能放出大量热的则为浓硫酸,应之为稀硫酸。②观察状态,浓H2SO4为粘稠液体,而稀硫酸为粘稠度较小的液体。③比较相同体积的酸的样品质量大小,浓硫酸质量较大,而稀硫酸则密度小。④取少量试样,向其中投入铁片,若产生大量气体的则为稀硫酸,若无明显现象(钝化),则为浓硫酸。⑤用玻璃棒蘸取试样在白纸上写字,立即变黑的为浓硫酸,反之则为稀硫酸。⑥取少量试样,分别投入一小块铜片,稍加热发生反应的为浓硫酸,无现象的为稀硫酸。(3)SO2和H2。浓硫酸与锌反应放出SO2气体,随着反应的进行浓硫酸变为稀硫酸,锌与稀硫酸反应放出H2。
三、推断题(11分)
28.(1)A:SiO2;B:Na2SiO3 ;C:CO2 ;D:H2SiO3
(2)SiO2+4HF
== SiF4↑+2H2O
SiO2+Na2CO3  Na2SiO3
+CO2↑
Na2SiO3
+CO2↑
Na2SiO3+CO2+H2O
= H2SiO3↓+Na2CO3 H2SiO3 SiO2+H2O
SiO2+H2O
29.(1)FeCl2 KCl (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe3++SCN-=Fe(SCN)2+ 2Fe3++Fe=3Fe2+
四、实验题(8分)
30.(1) ① 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
② 2NO+O2== 2NO2
(2) ① 有无色气泡产生,反应速度开始缓慢,逐渐加快;
② 试管中的气体由无色变为浅棕色,后又变为无色;
③ 试管中的溶液由无色变成浅蓝色;
④ 反应结束时,铜片全部溶解。
(3) ① 水进入试管,上升到一定高度
② 试管中气体的颜色由棕红色变为无色
五、计算题(共11分)
31.(6分)(1)97.3 % (2)2mol/L
32.(5分) ①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com