
题目列表(包括答案和解析)
(10分)(1)已知25℃时,1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ。写出该反应的热化学方程式:__________________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,在电极上分别吹入氢气和氧气。写出负极的电极反应式:_________________________。
该电池工作一段时间后正极区附近溶液的pH值将______(填:变大、变小或不变)。
(3)在相同条件下,1 mol H2直接燃烧产生的能量与设计成燃料电池产生的能量______(填:直接燃烧多、燃料电池多、一样多)。
(4)氢气是一种十分理想的清洁能源,目前还面临着储运中因沸点太低难以液化的问题,请简述氢气沸点很低的原因_____________________。
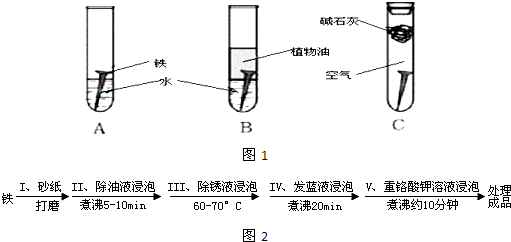
(14分)某研究小组对铁生锈进行研究:
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:
①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用
一、选择题(每小题2分,共20分。每小题只有一个选项符合题意。)
1―5DCADD 6―10DBBBA
二、选择题(每小题3分,共24分。每小题有1―2个选项符合题意。若有两个选项的,只选一个且正确的得1分。多选、错选均不得分。)
11.AC 12.BD 13.A 14.B 15.AD 16.C 17.BC 18.D
19.(共6分)
(1)2Fe2++Cl2=2Fe3++2Cl-(2分)
(2)AlCl3 Al(OH)3 Na[Al(OH)4] NaOH或CO2 NaHCO3 Na2CO3 NaOH
(共4分,每空1分)
20.(共12分。每空2分)
(1)①负极 2H++2e-=H2↑(或2H2O+2 e-=H2↑+2OH-)
②正极 2Cl-=Cl2↑+2e-(或2Cl―2e-=Cl2↑)
(2)变蓝 O2+2H2O+4e-=4OH-
21.(共13分)
 (1)A(g)+2B(g) C(g)+D(g) △H=-410kJ?mol-1(3分。状态、可逆符号、△H的数值、符号、单位有一处错误扣1分,本小题不出现负分。)
(1)A(g)+2B(g) C(g)+D(g) △H=-410kJ?mol-1(3分。状态、可逆符号、△H的数值、符号、单位有一处错误扣1分,本小题不出现负分。)
(2)增大 降低温度,平衡向放热反应方向(即正反应方向)移动,A的转化率增大(每空2分,第二空只要表达出“降低温度,平衡正向移动”的含义即可得分)
(3)[C][D]/[A][B]2 减小 (每空2分)
(4)A(2分)
22.(共17分)
(1)①玻璃棒、500mL容量瓶、胶头滴管(3分,对一个得1分)
|