
题目列表(包括答案和解析)
 2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:
2NH3(g);ΔH="-92.4" kJ·mol-1。请回答: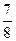 ,则N2的转化率a1= ,此时,反应放热 kJ;
,则N2的转化率a1= ,此时,反应放热 kJ;氨的合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:

(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为: ,
第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),
第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数
K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) ![]() 2NH3(g) +
2NH3(g) + ![]() O2(g) ;△H = a kJ·mol—1
O2(g) ;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(27分)氨的合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ;△H=—92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H=—92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:

(1)10min内以NH3表示的平均反应速率 ;
(2)在10~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为: ,
第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),
第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数
K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+ 3H2O(1) ![]() 2NH3(g)+
2NH3(g)+ ![]() O2(g) ;△H = a kJ·mol—1
O2(g) ;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g)+ O2(g) = 2H2O(l)= -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
回答下列问题:
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
 2NH3(g) +
2NH3(g) +  O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1(17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。

回答下列问题:
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为: ,第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) +
3H2O(1)  2NH3(g) +
2NH3(g) +  O2(g)
;△H = a kJ·mol—1
O2(g)
;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) +
3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
一、选择题(每小题3分,共30分。每小题只有一个正确选项)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
B
D
A
C
C
C
A
D
B
二、选择题(每小题2分,共18分。每小题只有一个正确选项)
题号
11
12
13
14
15
16
17
18
19
答案
B
D
C
B
A
C
D
A
D
三、(共23分)
20.(12分)
 |
(1)
(2)NH3?H2O NH4++OH-(2分) (3)1∶1(2分)
NH4++OH-(2分) (3)1∶1(2分)
(4)①NH4++H2O NH3?H2O+H+(2分)
NH3?H2O+H+(2分)
②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
21.(11分)
(1)bd(2分) (2)①25%(2分) 23.1 kJ(2分) ②>(2分)
(3)阴(1分) N2+6H++6e-=2NH3(2分)
四、(共11分)
22.(4分)
④②③⑤①(2分) Ag++Br-=AgBr↓(2分)
23.(7分)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分,合理答案给分)
MnCl2+Cl2↑+2H2O(2分,合理答案给分)
(2)防止G中水蒸气进入U型管(1分)
(3)2NOCl+H2O=N2O3+2HCl(或2NOCl+H2O=NO↑+NO2↑+2HCl)(2分)
(4)防止NO被装置中的氧气氧化为NO2;保持Cl2过量,使NO完全转化,避免
NO逸出污染空气(2分)
五、(共14分)
24.(14分)
(1)C2H6O2 (2分) 乙二醇(1分) (2)ac(2分)
 (3)CH3CH(OH)COOH CH2=CHCOOH+H2O(2分)
消去(1分)
(3)CH3CH(OH)COOH CH2=CHCOOH+H2O(2分)
消去(1分)
(4)CH2=CHCH2COOH(2分) CH3CH=CHCOOH(2分)
(5)
六、(共12分)
25.(12分)
(1)acd(2分) (2)HOCN(2分)
(3) (2分)
8HNCO+6NO2=7N2+8CO2+4H2O(2分)
(2分)
8HNCO+6NO2=7N2+8CO2+4H2O(2分)
(4)NH4++OH- NH3↑+H2O(2分) 2.8%(2分)
NH3↑+H2O(2分) 2.8%(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com