
题目列表(包括答案和解析)
碳族元素是形成化合物种类最多的元素。
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10 b.11 c.13 d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是 (选填序号)。
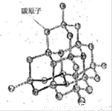
a.C-C键键角都为109°28’ b.最小的环由6个C原子构成
c.可溶于非极性溶剂 d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
碳族元素是形成化合物种类最多的元素。
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10 b.11 c.13 d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是 (选填序号)。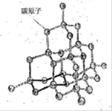
a.C-C键键角都为109°28’ b.最小的环由6个C原子构成
c.可溶于非极性溶剂 d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
(15分)四种主族元素的性质或结构信息如下:
| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |

第Ⅰ卷(选择题共74分)
一.二选择题:
题号
1
2
3
4
5
6
7
8
答案
C
D
A
B
C
B
B
C
题号
9
10
11
12
13
14
15
16
17
18
答案
C
AC
BC
C
B
D
D
C
B、C
C
第Ⅱ卷(选择题共76分)
19.(1)AEF (2)AB (3)AF(或AE) (4)D
(5)安全瓶防止碱液倒吸 (2分×5)
20.(1)C(1分), B (1分)
(2)B(1分) 负极:2Cu-4e- =2Cu2+ (2分) 正极:2H2O+O2+4e- ==4OH-(2分)
21.离子方程式(略)(1)、(3);(1)中F-还原性很弱,不能使Fe3+还原为Fe2+;
(3)中F-不与SCN-反应,SCN-没有被消耗,所以当再加入足量的FeCl3溶液时,溶液又呈血红色。 (2分×3)
22.(1)弱电解质
(2)H5IO6
5 H5IO6 + 2Mn2+ = 11 H+ +2 MnO4― + 5 IO3― + 7 H2O (2分×3)
23.(1)山坡上;(2)碳酸钠溶液或碳酸氢钠溶液浸湿毛巾;
(3)肥皂水(或洗衣粉)浸湿毛巾;
(4)氢氧化钠溶液或者氢氧化钙溶液;
(5)浓氨水。(2分×5)[其它合理答案也可]
24.(1)A:H2S D:H2SO4 2H2S+3O2 == 2SO2+2H2O;
(2)A:NH3 4NH3+5O2 == 4NO + 6H2O
(3)三、ⅠA族、略
(4)S 2SO2+O2 2SO3;C(略); N2 2NO+O2==2NO2
2SO3;C(略); N2 2NO+O2==2NO2
[(1)、(2)方程式2分,其它各1分,以上条件略写出,但评分时要斟情扣分]
25.(1)NH4Cl ,①;(2)NH4Cl 和NH3?H2O(过量), NH4Cl 和HCl(过量)
(3)小于 ,大于 (1分×6)
26.解答:(1)AB (2分)(2)除去过量的铁屑(1分)(3) Fe2(SO4)3 ;废铁屑中含有氧化生成Fe2O3(或Fe3O4)被H2SO4溶解生成Fe2(SO4)3。FeSO4被空气氧化生成Fe2(SO4)3;取少许滤液,加KSCN溶液,观察溶液是否变血红色。(3分)
(4)解法一:若反应后得到的FeSO4在
x= ==34.17(mL)<50mL
==34.17(mL)<50mL
所以,蒸发后溶液尚未饱和. (3分)
解法二:若该溶液是饱和的,则其所含的 FeSO4溶质的质量为y 则
y==50×1.36× ==22.24(g)
==22.24(g)
按题意 H2SO4完全反应得到的 FeSO4的质量为:
0.5 × 200 ×10-3 ×152 =15.2
因
(5)C;(4)中求证
(
(6)(3分)解法一:
①(5)中所给
50.0ml ×
②设析出的FeSO4?7H2O的质量为X,则可列出
 =
= x=
x=
解法二:
 ×100%=17.0%
×100%=17.0%
则(50.0×1.30-x)× +
x×
+
x× =15.2
=15.2
x=11.0 (g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com