
题目列表(包括答案和解析)
A.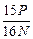 ×100% ×100% | B. ×100% ×100% |
C.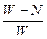 ×100% ×100% | D.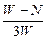 ×100% ×100% |
A.《物质结构与性质》模块(12分)
二茂铁【(C5H5)2 Fe】是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:
2C5H6+Fe(还原铁粉)![]() (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),![]() 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
B.《实验化学》模块(12分)
(12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是: 。
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入 (填化学式)试剂可达这一目的。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”)。
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN
(填“>”或“<”)。
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
B.对氨基
苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
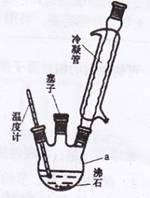
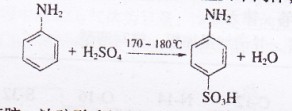
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100 ![]() ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
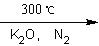 (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。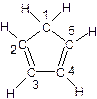 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),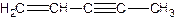 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;A.下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计、②容量瓶、③滴定管、④烧杯、⑤蒸馏烧瓶、⑥量筒、⑦玻璃棒、⑧蒸发皿
在仪器上具体标明使用温度的是(不考虑温度计)________(填编号);
标有“0”刻度的有________(填编号)
对允许加热的仪器,加热时必须垫上石棉网的有________(填编号);
使用时必须检查是否漏水的有________(填序号);
B:现用物质的量的浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是________;
②下图是酸式滴定管中液面在滴定前后的读数:
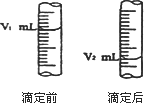
则c(NaOH)=________;
C:拟在烧杯中于加热条件下配置某溶液50 mL,应选择的烧杯是(用字母回答)________
A、400 mL
B、250 mL
C、100 mL
D、50 ml
D:“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气.在下列仪器中:
①试管
②分液漏斗
③细口试剂瓶
④广口试剂瓶
⑤集气瓶
⑥滴瓶
肯定用不到“磨砂”处理的有________(填序号).
第Ⅰ卷(选择题共74分)
一.二选择题:
题号
1
2
3
4
5
6
7
8
答案
C
D
A
B
C
B
B
C
题号
9
10
11
12
13
14
15
16
17
18
答案
C
AC
BC
C
B
D
D
C
B、C
C
第Ⅱ卷(选择题共76分)
19.(1)AEF (2)AB (3)AF(或AE) (4)D
(5)安全瓶防止碱液倒吸 (2分×5)
20.(1)C(1分), B (1分)
(2)B(1分) 负极:2Cu-4e- =2Cu2+ (2分) 正极:2H2O+O2+4e- ==4OH-(2分)
21.离子方程式(略)(1)、(3);(1)中F-还原性很弱,不能使Fe3+还原为Fe2+;
(3)中F-不与SCN-反应,SCN-没有被消耗,所以当再加入足量的FeCl3溶液时,溶液又呈血红色。 (2分×3)
22.(1)弱电解质
(2)H5IO6
5 H5IO6 + 2Mn2+ = 11 H+ +2 MnO4― + 5 IO3― + 7 H2O (2分×3)
23.(1)山坡上;(2)碳酸钠溶液或碳酸氢钠溶液浸湿毛巾;
(3)肥皂水(或洗衣粉)浸湿毛巾;
(4)氢氧化钠溶液或者氢氧化钙溶液;
(5)浓氨水。(2分×5)[其它合理答案也可]
24.(1)A:H2S D:H2SO4 2H2S+3O2 == 2SO2+2H2O;
(2)A:NH3 4NH3+5O2 == 4NO + 6H2O
(3)三、ⅠA族、略
(4)S 2SO2+O2 2SO3;C(略); N2 2NO+O2==2NO2
2SO3;C(略); N2 2NO+O2==2NO2
[(1)、(2)方程式2分,其它各1分,以上条件略写出,但评分时要斟情扣分]
25.(1)NH4Cl ,①;(2)NH4Cl 和NH3?H2O(过量), NH4Cl 和HCl(过量)
(3)小于 ,大于 (1分×6)
26.解答:(1)AB (2分)(2)除去过量的铁屑(1分)(3) Fe2(SO4)3 ;废铁屑中含有氧化生成Fe2O3(或Fe3O4)被H2SO4溶解生成Fe2(SO4)3。FeSO4被空气氧化生成Fe2(SO4)3;取少许滤液,加KSCN溶液,观察溶液是否变血红色。(3分)
(4)解法一:若反应后得到的FeSO4在
x= ==34.17(mL)<50mL
==34.17(mL)<50mL
所以,蒸发后溶液尚未饱和. (3分)
解法二:若该溶液是饱和的,则其所含的 FeSO4溶质的质量为y 则
y==50×1.36× ==22.24(g)
==22.24(g)
按题意 H2SO4完全反应得到的 FeSO4的质量为:
0.5 × 200 ×10-3 ×152 =15.2
因
(5)C;(4)中求证
(
(6)(3分)解法一:
①(5)中所给
50.0ml ×
②设析出的FeSO4?7H2O的质量为X,则可列出
 =
= x=
x=
解法二:
 ×100%=17.0%
×100%=17.0%
则(50.0×1.30-x)× +
x×
+
x× =15.2
=15.2
x=11.0 (g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com