
题目列表(包括答案和解析)
化学反应原理对于工业生产和科研有重要意义
I、下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
| 化学反应 | 平衡常数 | 温度 | |
| 973 K | 1173 K | ||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) | K3 | ? | ? |


| 化学反应 | 平衡常数 | 温度 | |
| 973 K | 1173 K | ||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) | K3 | ? | ? |
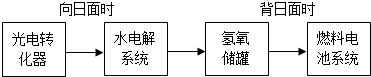
I、已知反应:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式
 K= 。
K= 。
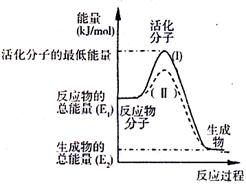
(2)右图表示反应过程中有关物质的能量,则反应
的 △H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。
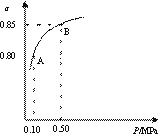 根据图示回答下列问题。
根据图示回答下列问题。
①平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,
在体积不变的条件下,下列选项中有利于提高SO2平衡转
化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气
节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机十自动变速器十20kW十200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式???????????? 。
 ②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应?????????????????????????????????? 。其放电时的正极的电极反应方程式为???????? 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应?????????????????????????????????? 。其放电时的正极的电极反应方程式为???????? 。
③常温下,同浓度的Na2CO3溶液和NaHCO3溶液的pH都大于7,两者中哪种的pH更大,其原因是???? 。0.1mol·L-1 Na2CO3中阴离子浓度大小关系是??? ,向0.1mol·L-1 NaHCO3溶液中滴入少量氢氧化钡溶液,则发生反应的离子方程式为:????????????? 。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)
联合生产二氧化锰、锌的工艺如下:

①操作Ⅰ需要的玻璃仪器是?????? 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为 ????? ,上述电解过程中,当阴极生成6.5g B时阳极生成的MnO2的质量为 ???? 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为?????? 。
节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机十自动变速器十20kW十200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式 。 ②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
③常温下,同浓度的Na2CO3溶液和NaHCO3溶液的pH都大于7,两者中哪种的pH更大,其原因是 。0.1mol·L-1 Na2CO3中阴离子浓度大小关系是 ,向0.1mol·L-1 NaHCO3溶液中滴入少量氢氧化钡溶液,则发生反应的离子方程式为: 。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)
联合生产二氧化锰、锌的工艺如下:
①操作Ⅰ需要的玻璃仪器是 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为 ,上述电解过程中,当阴极生成6.5g B时阳极生成的MnO2的质量为 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为 。
一、选择题(本题包括21小题,每小题2分,共42分。)
1.D 2.C 3.C 4.D 5.C 6.C 7.D 8 .D 9.C 10.C
11.B 12.C 13.C 14.C 15.D 16.C 17.B 18.D 19.B 20.A二、本题包括1小题,共12分。
21.(12分)
(1)B中装无水硫酸铜,检验水蒸气;C中装澄清的石灰水,检验二氧化碳;(每空1分)
(2)验纯后点燃E处的气体,火焰呈蓝色。(2分,不答“验纯”扣1分)
(3)点燃前应验纯;CO有毒,实验要通风;加热时要均匀受热等。(2分)
(4)挥发出来的草酸蒸气与石灰水反应生成了草酸钙沉淀,会干扰 的检验(2分)
的检验(2分)
在装置B和C装置间增加―个装有水(或烧碱溶液)的洗气装置(2分)
三、本题包括3小题,共38分。
22.(每空2分,共12分)
(1)
 (2) >
(2) >
(3)
(4) (5) 336
(5) 336
23.(每空2分,共12分)
(1)A:Si B:Mg (2)抑制氯化镁水解
(3) ①
③
④
24.(每空2分,共14分)
(1) (2)
(2)
(3) 负极反应产物
负极反应产物
(4)①
②
③
四、本题包括1小题,共10分。
25.(1) (2分)
(2分)
 (2分)
(2分)
(2)解:设生成 的物质的量为
的物质的量为 。由上述方程式知:
。由上述方程式知:






生成 的质量为:
的质量为: (2分)
(2分)
(3)①5、1、8、1、5、4 (2分) ②83.33% (2分)
(2分) ②83.33% (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com