
题目列表(包括答案和解析)
乙醇俗称酒精,在生活中用途广泛,工业上可用来制造醋酸、饮料、香精、染料、燃料等,医疗上也常用体积分数为70%~75%的乙醇作消毒剂。某校初三学生在老师的指导下对乙醇的一些性质进行了实验探究:
【探究活动一】乙醇的化学式是C2H5OH,在NaOH一样含有“OH”,那么乙醇是不是碱呢?请你试设计一种方案加以验证.
| 实验步骤 | 实验现象 | 实验结论 |
| | | 乙醇不是碱 |

| 实验步骤 | 实验现象 | 实验结论 |
| | | 小红同学的想法是正确的,有关实验现象的反应化学方程式为 |
乙醇俗称酒精,在生活中用途广泛,工业上可用来制造醋酸、饮料、香精、染料、燃料等,医疗上也常用体积分数为70%~75%的乙醇作消毒剂。某校初三学生在老师的指导下对乙醇的一些性质进行了实验探究:
【探究活动一】乙醇的化学式是C2H5OH,在NaOH一样含有“OH”,那么乙醇是不是碱呢?请你试设计一种方案加以验证.
|
实验步骤 |
实验现象 |
实验结论 |
|
|
|
乙醇不是碱 |
【探究活动二】根据质量守恒定律,小李同学认为乙醇(C2H5OH)完全燃烧时生成CO2和H2O,如果氧气不足,乙醇燃烧可生成CO、CO2和H2O。
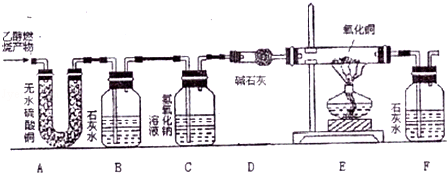
查阅资料:无水硫酸铜固体遇水由白色变蓝色,生成五水硫酸铜(CuSO4•5H2O),一氧化碳具有还原性,高温或加热时能将许多金属氧化物还原金属单质,因此常用于金属的冶炼.碱石灰是氧化钙和氢氧化钠的混合物,具有很强的吸水性,并能吸收酸性气体。
在老师的指导下,同学们用如图所示的装置进行实验,确证乙醇燃烧产物中有CO、CO2和H2O。请回答下列问题:

(1)B装置的作用是 ;C装置的作用是 ;D装置的作用是 。
(2)能确证产物中有H2O的现象是 。实验时,同学们还观察到B、F装置中澄清石灰水变浑浊,C装置中有气泡冒出,E装置中黑色粉末变成红色,说明该乙醇燃烧产物中有CO、CO2和H2O生成.请写出E装置中发生反应的化学方程式: 。
(3)为了保护环境,应在装置的排气管口采取的措施是 。
(4)小明同学在反应的过程中发现C装置内除了气体通过溶液时产生气泡之外,没有明显变化现象,所以他认为C装置中没有发生化学反应,小红同学认为通过C装置气体中仍有部分二氧化碳与氢氧化钠溶液发生化学反应,为了确证C装置中是否发生化学变化,他们设计了以下实验:
|
实验步骤 |
实验现象 |
实验结论 |
|
|
|
小红同学的想法是正确的,有关实验现象的反应化学方程式为 |
| 实验步骤 | 实验现象 | 实验结论 |
| | | 乙醇不是碱 |
| 实验步骤 | 实验现象 | 实验结论 |
| | | 小红同学的想法是正确的,有关实验现象的反应化学方程式为 |
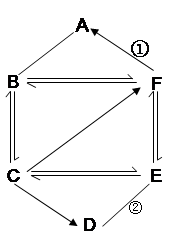
(6分)A~G是初中化学常见的物质,其转化关系如下图所示。其中,A是一种紫黑色固体,在加热的条件下能生成B、D、E三种物质;B和G均是黑色固体,B和F的溶液混合后也能产生D;D和J都是无色无味的气体,J能用于光合作用和灭火。
(1)写出下列字母代表的物质的名称:A ;B 。
(2)G在D中燃烧的实验现象是___________。文字表达式为 。
(3)L的溶液俗称为 。写出J与L反应的文字表达式 。
一、选择题(共25个小题,每个小题1分,共25分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
A
B
D
D
C
D
C
B
A
C
A
C
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
D
B
B
A
B
D
C
C
D
A
D
B
二、填空题(共5个小题,共30分)
26.(共9分,每空1分)
/2009年北京市延庆县第一学期期末统测初三化学.files/image068.gif) (1)Al O H (2)FeCl3 +4
(1)Al O H (2)FeCl3 +4
(3)B C H2、O2(或Cl2) 2H2+O2 2H2O
27.(共5分,每空1分)
(1) D
(2) 生成物为CO2和H2O,不污染空气
/2009年北京市延庆县第一学期期末统测初三化学.files/image069.gif)
(3)2H2O 2H2↑+O2↑ (4) N2 (5)A、B、C
28.(共5分,每空1分)
(1) 氯化钠(或NaCl) (2) 饱和
(3) 碳酸钠溶解度随温度降低而明显降低,冬天温度低,溶解在水中的碳酸钠就析出,所以冬天可捞碱。 (4) 25 <
29.(共5分)
(1)下降 镁与稀硫酸反应放热,致使瓶内气压大于外界气压(合理即给分)
(2) B、C
(3) ①化学反应常伴有能量变化 ②分子之间有间隔 (2分)(合理即给分)
30.(共6分)
(1)O2 熟石灰
(2)CO2 + Ca(OH)2 == CaCO3↓+ H2O CO + H2O = H2CO3
(3) C、H(或H、Cl) (2分,答对1种元素给1分)
三、实验题(共3个小题,共19分)
/2009年北京市延庆县第一学期期末统测初三化学.files/image070.gif) 31.(共8分,每空1分)
31.(共8分,每空1分)
(1) 锥形瓶 (2)A B 2H2O2 2H2O+O2↑
(3) b、c、d、a
(4) CaCO3+2HCl→CaCl2+H2O+CO2↑; C ①③
32.(共5分,每空1分)
密度比空气密度大、不能燃烧、不能支持燃烧(三点答全得1分)
(1)杯内的氧气被耗尽,同时又产生了不能燃烧且不能支持燃烧的气体。(合理即给分)
蜡烛燃烧产生的CO2密度大,会下沉。 高的
(2)①②
33.(共6分,每空1分)
【实验设计】 氧气(或O2) ;
增加水中的氧气含量,供鱼苗呼吸
【实验反思】 氧化钙与水反应,生成氢氧化钙。或CaO+H2O→Ca(OH)2
实验步骤
实验现象
结论
取反应后所得溶液样品于试管中,然后通入CO2气体。
产生白色沉淀(或溶液变浑浊)
2CaO2+2H2O→2Ca(OH)2+O2↑
四、计算题(共2个小题,每小题3分,共6分。最后结果保留一位小数)
34.(共3分,每空1分)
(1) 6∶1 ; 66.7% (2)
35.(共3分)
【解】设:生成次氯酸钠的质量为X,氢气的质量为y
MNaCl ==11.7%×
/2009年北京市延庆县第一学期期末统测初三化学.files/image071.gif) 则:NaCl+H2O
NaClO+H2↑
则:NaCl+H2O
NaClO+H2↑
58.5 74.5 2
/2009年北京市延庆县第一学期期末统测初三化学.files/image072.gif)
|