
题目列表(包括答案和解析)
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图所示,下列说法正确的是
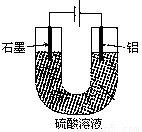
A.阳极电极方程式为: Al—3e—+6OH—=Al2O3+H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36L(标况)时,阳极增重2.4g
D.电解过程中H+移向Al电极
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图所示,下列说法正确的是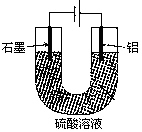
| A.阳极电极方程式为: Al—3e—+6OH—=Al2O3+H2O |
| B.随着电解的进行,溶液的pH逐渐增大 |
| C.当阴极生成气体3.36L(标况)时,阳极增重2.4g |
| D.电解过程中H+移向Al电极 |
(15分)A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、内为常见的化合物,甲物质具有磁性。它们之间有如图1的转化关系:
请回答下列问题:
(1)B与甲反应的化学方程式是 。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。
(4)电浮选凝聚法是工业上采用的一种污水处理方法,如图2是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。
阳极的电极反应分别是 ,2H2O-4e-=4H++O2↑;
阳极区生成沉淀的离子方程式是 。
(15分)A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、内为常见的化合物,甲物质具有磁性。它们之间有如图1的转化关系:

请回答下列问题:
(1)B与甲反应的化学方程式是 。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。
(4)电浮选凝聚法是工业上采用的一种污水处理方法,如图2是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。

阳极的电极反应分别是 ,2H2O-4e-=4H++O2↑;
阳极区生成沉淀的离子方程式是 。
A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、内为常见的化合物,甲物质具有磁性。它们之间有如图1的转化关系:
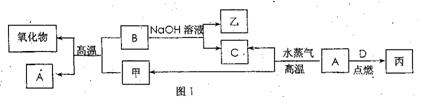
请回答下列问题:
(1)B与甲反应的化学方程式是 。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。
(4)电浮选凝聚法是工业上采用的一种污水处理方法,如图2是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。
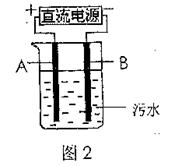
阳极的电极反应分别是 ,2H2O-4e-=4H++O2↑;
阳极区生成沉淀的离子方程式是 。
1、B 2、C 3、D 4、A 5、D 6、A 7、D 8、C 9、AC 10、D 11、D 12、BD 13、AB 14、A
15.(12分)
1、(1)Br2;Fe3+ (每空2分,共4分)
(2)假设1方案:向黄色溶液加入CCl4,振荡,静置,下层溶液呈橙红色。(2分)
假设2方案:向黄色溶液滴加KSCN溶液,溶液变为(血)红色 (2分)
2、假设2 (1分);不可行(1分);因为Br2和Fe3+都能把I―氧化成I2使溶液都变蓝,无法得出结论。(2分)
3、2 Fe2+ + 4 Br- + 3Cl2 == 2 Fe3+ +2 Br2 + 6Cl- (2分)
16、
17、各元素分别为A :H B :O C: Na D:S
各物质为
a:SO2
b:SO
18.(10分)
(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
19(10分)(1)①②④ (2)羧基 碳碳双键
 20.(1)① 1(2分);672(2分)② 0.56(2分)
20.(1)① 1(2分);672(2分)② 0.56(2分)
(2)520∽787(2分)
(3)见右图(4分,部分正确酌情给分)
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
(1)I.IIIA (1分)
II.IVA (1分);b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水。 (1分)
(2)I.3d24S2 (2分)
II.①BaTiO3 (2分) 6 (2分)
②[TiCl(H2O)5]Cl2 ?H2O(3分)
21.B⑴2NH3
+ 3CuO  3Cu +
N2 + 3H2O
。
3Cu +
N2 + 3H2O
。
⑵利用NaOH的碱性和遇水放热的性质,使NH3?H2O 分解后逸出 。
⑶ C (填序号);
⑷黑色固体变成了亮红色 。
⑸吸收多余的NH3 ;
⑹
⑺减少 ,因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加。
本资料由《七彩教育网》www.7caiedu.cn 提供!
本资料来源于《七彩教育网》http://www.7caiedu.cn
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com