
题目列表(包括答案和解析)
方案一:
(1)称取碳酸钙样品Mg;
(2)用cmol·L-1的盐酸VmL(过量)溶解样品;
(3)取溶解后的溶液的十分之一,用c′mol·L-1NaOH溶液滴定,恰好用去V′mL。
问题①:列出本实验中所用到的玻璃仪器名称_____________________________________。
问题②:加盐酸后是否需要滤出SiO2后再用NaOH溶液滴定__________(填选项代号)
A.需要 B.不需要 C.均可
问题③:碳酸钙纯度计算公式___________________________________________。
方案二:
(1)称取碳酸钙样品Mg;
(2)高温烧煅到1 000℃直至质量不再改变,冷却后称量,质量为M′g。
问题①:为什么要煅烧至1 000℃且“直至质量不再改变”?
______________________________________________________________
问题②:本方案中的“冷却”应如何操作?
______________________________________________________________
方案三:
(1)称取碳酸钙样品Mg;
(2)加入足量cmol·L-1盐酸VmL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′mol·L-1Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出洗涤,干燥、称重为M′g。
问题①:此方案中可以不需要的数据是__________(填选项代号)。
A.c、V B.c′、V′ C.M′ D.M
问题②:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定结果:碳酸钙纯度将_________(偏高、偏低、无影响)
综上所述,你认为三个方案中,最好的方案是__________。其他方案的缺点分别是:方案三:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。方案_________,_________。
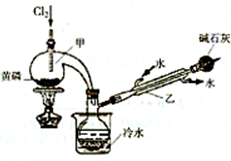
| 熔点/℃ | 沸点/℃ | 密度/g?mL | 其他 | |||||||||
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2
2P+5Cl2(过量)
| ||||||||
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 | ||||||||
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于 PCl3 |
| ||
| ||
(c1V1-
| ||
| m |
(c1V1-
| ||
| m |
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
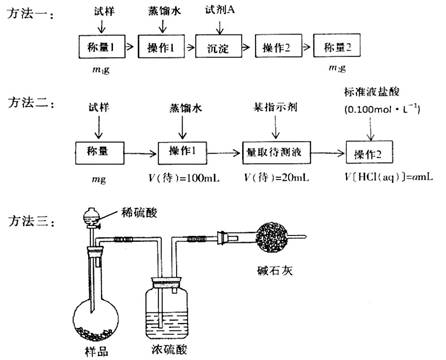
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一是将HCO3-离子转化为沉淀并称重,则试剂A为______________(填化学式)溶液;操作2包括_______________________。
(2)方法二操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要___________________;操作2的名称是__________;该样品中NaHCO3的质量分数为_________(用含m、a的表达式表示)。
(3)根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是_______________;仔细分析该实验装置,由此测得的数据计算出的实验结果有可能偏高也有可能偏低,偏高的原因可能是______________________________;偏低的原因可能是____________________________。
(4)方法四的实验原理是________________(用化学方程式表示)。
(15分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)
(1)仪器乙的名称 ;
(2)实验室制备Cl2的离子方程式: ;
(3)碱石灰的作用是 , ;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是 。
(二)提纯
粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过____(填实验操作名称),即可得到PCl3的纯品。
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示、不必化简)
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施_______________________。

(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①__________________________________________________________________,
②__________________________________________________________________。
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品mg,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色至无色(指示![]() +H+
+H+![]()
![]() 反应的终点),消耗HCl溶液体积为V1mL,再加入1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++
反应的终点),消耗HCl溶液体积为V1mL,再加入1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++![]()
![]() CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2mL。则烧碱样品中Na2CO3的质量分数为_____________________。
CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2mL。则烧碱样品中Na2CO3的质量分数为_____________________。
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤。
②用测得的数据(用字母表示)写出质量分数的表达式_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com