
题目列表(包括答案和解析)
I、NaOH、FeCl3是中学化学实验室常用的试剂。
(1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中;
C.定容时观察液面俯视
D.溶解后未经冷却立即转移至容量瓶内
(2)FeCl3可以腐蚀蚀刷电路铜板,反应的离子方程式为________________________________K2FeO4是一种强氧化剂,可作为水处理剂和高容量电池材料。K2FeO4可以由与FeCl3 与KClO在强碱性条件下反应制得,其反应的离子方程式为
______________________________________________.
Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们
的日常生产和生活。
已知:

(1)反应
(2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向_________极(填“正”或“负”);电池的负极反应为_____________________________.
(3)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。
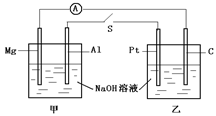
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.Mg、Al为电极,NaOH溶液为电解质溶液所构成的原电池中,导线上流过NA个电子,
则正极放出标准状况下氢气的体积为11.2L
B.1 mol C10H22分子中共价键总数为30NA
C.58.5g氯化钠可以构成NA个如图所示的结构单元

D.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数为NA
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
| A.Mg、Al为电极,NaOH溶液为电解质溶液所构成的原电池中,导线上流过NA个电子, 则正极放出标准状况下氢气的体积为11.2L |
| B.1 mol C10H22分子中共价键总数为30NA |
C.58.5g氯化钠可以构成NA个如图所示的结构单元 |
| D.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数为NA |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com