
题目列表(包括答案和解析)
(1)铝元素在周期表中处于____________(填周期数、主族数);Al3+的结构示意图为____________。
(2)无机富锌涂料在防止钢铁腐蚀的过程中,锌电极上的电极反应为,掺入少量铝粉的无机富锌涂料能使钢铁抗腐蚀能力增强的可能原因之一是________________________。
(3)铝热反应在冶炼金属及定向爆破等实际应用中有着重要的用途。铝和氧化铁在高温条件下反应,当转移3 mol电子时,产生铁的质量是____________g。
(4)铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的复盐,当向铝铵矾稀溶液中逐滴加入0.1 mol·L-1NaOH溶液出现了如下a、b、c三个阶段的图象
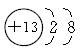
根据上图完成下列离子反应方程式:
b阶段:________________________________________________;
c阶段:________________________________________________。
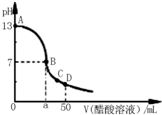 常温下,向25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1 mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1 mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
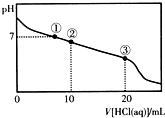 常温下,向20.00mL 0.100mol/L CH3COONa溶液中逐滴加入0.1 000mol/L盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.100mol/L CH3COONa溶液中逐滴加入0.1 000mol/L盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )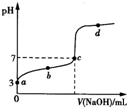 已知常温下CH3COOH的电离平衡常数为K.该温度下向20mL 0.1 mol?L-1 CH3COOH溶液中逐滴加入0.1 mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知常温下CH3COOH的电离平衡常数为K.该温度下向20mL 0.1 mol?L-1 CH3COOH溶液中逐滴加入0.1 mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com