
题目列表(包括答案和解析)
已知工业制氢气的反应为CO(g) + H2O(g) CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
(1)增加H2O(g)的浓度,CO的转化率将 (填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K = 。400 ℃时的平衡常数K 9(填“>”“<”或”“=”)。
(3)500 ℃时,10min内v(H2O)= ,在此过程中体系的能量将 (填“增加”或“减少”) kJ。
(4)已知 2H2 (g) + O2 (g) = 2H2O(g) ΔH=-484kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式: 。
A.2H2(g)+O2 (g)====2H2O (g);ΔH=+573.6 kJ/mol
B.2H2(g)+O2 (g)====2H2O (1);ΔH=一143.4 kJ/mol
C.2H2(g)+O2 (g)====2H2O (1);ΔH=一573.6 kJ/mol
D.2H2(g)+O2 (g)====2H2O (1);ΔH=+573.6 kJ/mol
(1)下列各组类比中正确的是( )
A.由NH4Cl![]() NH3↑+HCl↑ 推测:NH4I
NH3↑+HCl↑ 推测:NH4I![]() NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O====CaCO3↓+2HClO 推测:SO2+Ca(ClO)2+H2O====CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O====Ca(HCO3)2+2HClO 推测:CO2+NaCIO+H2O====NaHCO3+HClO
D.由Na2SO3+2HCl====2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3====2NaNO3+H2O+SO2↑
(2)根据2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑的反应原理例举一个制取类似气体的反应(写出方程式)________________________________________。
Na2SO4+2HCl↑的反应原理例举一个制取类似气体的反应(写出方程式)________________________________________。
(3)由氢氧化铁与盐酸反应生成氯化铁和水,应用有关知识,推断氢氧化铁与氢碘酸的化学方程式____________________________________________。
(4)从2F2+2H2O=====4HF+O2反应,预测2F2+4NaOH====4NaF+2H2O+O2,然而经过实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学方程式________________________________________。
已知工业制氢气的反应为CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。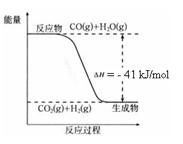
(1)增加H2O(g)的浓度,CO的转化率将 (填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K = 。400 ℃时的平衡常数K 9(填“>”“<”或”“=”)。
(3)500 ℃时,10 min内v(H2O)= ,在此过程中体系的能量将 (填“增加”或“减少”) kJ。
(4)已知 2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式: 。
A.2Al+2NaOH+6H2O![]() 2Na[Al(OH)4]+3H2↑
2Na[Al(OH)4]+3H2↑
B.2H2+O2![]() 2H2O
2H2O
C.Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com