
题目列表(包括答案和解析)
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:
它所对应的化学反应为:
(2)已知在一定温度下,
C(s)+CO2(g) ![]() 2CO(g)平衡常数K1;
2CO(g)平衡常数K1;
CO(g)+H2O(g ![]() H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)![]() CO(g)+H2(g) 平衡常数K3;
CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是: 。 高考资源网
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
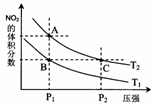 (4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) ![]() 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C ks5u
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是 。
ks5u
 (6)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式 ,阳极区逸出气体的成分为 __________(填化学式)。
(6)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式 ,阳极区逸出气体的成分为 __________(填化学式)。
1B
3D
5D
10BC
12AD
13BD
14BC
15.(12分)(1)x=1.5 (2)c(3)2Na2CO4=2Na2CO3+O2↑
(4)2CO42-+4H+=2CO2↑+O2↑+H2O
(5)g→h→e→f→d→c→b,
16.(8分)(1)CO(NH2)2 (2)AlO2-+CO2+H2O==Al(OH)3↓+HCO3-
(3)2Al2O3+2N2+
(4)CO2在水中的溶解度远小于NH3,若先通入CO2,则反应③中K的产率很低
17.(12分)(1)①(1分) (2)①②⑤(2分)
NO+NO2+2NaOH=2NaNO2+H2O(1分) 88.5%(2分)
(3)4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4(2分)
2Fe2(SO4)3+2H2SO4(2分)
Cu2S+10Fe3++4H2O 2Cu2++10Fe2++8H++SO42-(2分)
2Cu2++10Fe2++8H++SO42-(2分)
(4)3NO=N2O十NO2(1分),由于2NO2 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强路小于1.01×107 Pa的2/3(1分)
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强路小于1.01×107 Pa的2/3(1分)
18.(10分)(1)ABEF(2分)
(2)c(SO42-)>c(Fe2+)>c(H+)>c(OH-) (2分)
(3)硫酸作用Fe2+抑制的水解,铁皮的作用防止Fe3+的氧化。(2分,各1分)
(4)在试管中取滤液少许,加入足量的NaOH溶液,加热,用湿润的红色石蕊试纸检验,若试纸变兰色,则证明滤液中含有NH4+。(2分)
(5)FeSO4+2NH4HCO3 →FeCO3↓+( NH4)2 SO4+ CO2↑+H2O(2分)
19. (12分)(1)F: I:  (2分)(2)加成、消去 (2分)
(2分)(2)加成、消去 (2分)
 |
(4)4 (2分)
(5)
 |
20(8分)(1)Cu+2H++H2O2==Cu2++2H2O (2分) (2) 淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去。(2分)
(3)n(Cu)=1/2n(I2) = n(S2O32-)=6.45×0.01100=0.07095mmol
ωCu=0.07095×10-3×64×250.00/50.00/1.1=0.02064(4分)
21.(10分)(5)2分,其它每空1分
(1)Ar (2)极性 (3)5 1 (4)D是CH3OH,分子之间能形成氢键
(5)CO中第一个π键的键能是273kJ/mol,N2中第一个π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。
(6)1s22s22p63s23p6 3d104s1
(7)分子晶体
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com