
题目列表(包括答案和解析)
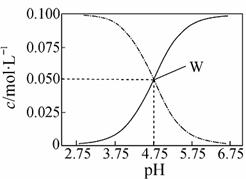
25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关叙述不正确的是
A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-) >c(H+)>c(OH-)
B.由图可知该温度下醋酸的电离常数为1×10-4.75
C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向1L W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):
2c(H+)+ c(CH3COOH)= c(CH3COO-)+2c(OH-)+2 c(Cl-)
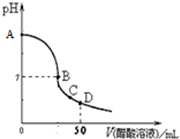
| A.在A点,溶液的pH=13 |
| B.在B点,c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.在C点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+) |

| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 甲基橙 | 甲 |
| C | 碱 | 酸 | 酚酞 | 甲 |
| D | 酸 | 碱 | 酚酞 | 乙 |

A.在0.1 mol/L CH3COOH溶液中,c(H+)=c(CH3COO-)+c(OH-)
B.常温下将10 mL 0.02 mol/L NaOH溶液与10 mL 0.02 mol/L H2SO4溶液充分混合,若混合后溶液的体积为20 mL,则混合后溶液的pH=2
C.在0.1 mol/L NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-)
D.在0.1 mol/L Na2CO3溶液中,![]() )+c(
)+c(![]() )
)
一. 选择题:(3分×16=48分)
题 号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答 案
D
C
A
A
C
D
A
D
C
B
D
D
B
A
C
C
二.(本题共14分)
17:Ⅰ.(4分,每空1分)(1)AEF;(2)BDE ;AF;(3)F>A>C>B>E。
Ⅱ.(10分)本题答案有开放性,合理即可给分。
⑴①C(或Fe) (1分) ②
⑵CuO(Fe2O3等)(1分)
⑶①CaC2+2H2O=Ca(OH)2+C2H2↑ ;(2分) ②麦芽糖;(1分)
⑷①Na2CO3+CO2+H2O=2NaHCO3 ;(2分) ②红褐色固体。(1分)
三.(本题共20分)
18.(10分)(1)高氯酸 (1分) (2)离子键和非极性键 (1分)
(3)2I-+ClO-+H2O=I2+Cl-+2OH- (2分)
(4)2H++2e- = H2↑ (2分) 0.71g (2分)
(5)2H2(g)+O2(g)=2H2O(g) ΔH=-4QkJ/mol (2分)
19.(10分)
(1)③④⑥(2分) (2)Ca(OH)2 或 Ba(OH)2(2分)
(3)2Na + 2H2O = 2Na++ 2OH- + H2↑(2分)
(4)氧化还原:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ (2分)
非氧化还原:AlCl3 + 4NaOH = NaAlO2 +3NaCl +2H2O (2分)
或Al(OH)3 + NaOH = NaAlO2 + 2H2O
或Al2O3 + 2NaOH = 2NaAlO2 + H2O
(其它合理答案酌情给分)
四. (本题共9分) (每空1分)
20.Ⅰ(1)关闭分液漏斗的活塞,在B中加水至浸没长导管口,用酒精灯微热(或用手热),长导管口有气泡冒出,停止加热,长导管内形成一段水柱,说明装置的气密性良好。
(2)圆底烧瓶; 常温下,Fe在浓硫酸中钝化,碳不与浓硫酸反应
(3)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O; 品红溶液逐渐褪色
CO2↑+2SO2↑+2H2O; 品红溶液逐渐褪色
(4)2Fe3++Fe=3Fe2+(或Fe+2H+=Fe2++H2↑)
(5)铁碳在酸溶液中形成原电池
Ⅱ(6) (7)C
(7)C
五.(本题共9分) 21.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com