
题目列表(包括答案和解析)
 置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):
置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):
| ||
| ||
置换反应的通式可表示为:
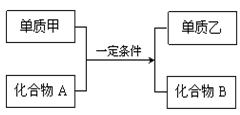
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3![]() Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是 ,A非常细,导光能力很强,可用作 。
置换反应的通式可表示为:
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是 ,A非常细,导光能力很强,可用作 。
置换反应的通式可表示为: 
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3 Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是 ,A非常细,导光能力很强,可用作 。
置换反应的通式可表示为:

请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3 Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是 ,A非常细,导光能力很强,可用作 。
1.D2.D3.C 4.B 5.C
6.A 7.B 8.D 9.C 10.A 11.D 12.A13.B
14、BD15、AC16、D17、C 18、AB 19、A20、C 21、C
22.答案(1)A、B、C、E、G、H、I
(2) 原理图2分,电流表外接和变阻器分压各1分,实物连线图4分,电流表外接和变阻器分压各1分,开关接通后输出电压最小1分,电流方向与电表极性一致1分。(3)设长度为L,截面外边长为a,电压为U,电流强度为I。电阻R= =
= ,截面积s=
,截面积s= 故有a2-
故有a2- =
= 解得d=
解得d= =2
=2
23.(15分)
解析:单摆首次摆到最低点的时间t1= T=
T=

B球下落的时间t2=
T1=t2 得a=8m/s2
 =0.2
=0.2
24.(19分)(5)PA-PRn=0 (1) P= (2)
(2)
Ek+EkRn=4.581×10-12J (3)
由(1)、(2)、(3)式得
Ek2=5.55×10-12J
EkRn=0.10×10-12J
(6)f= r=
r= ra=
ra= =0.5m
=0.5m
由r= 得
得  =
= rRn=0.012m
rRn=0.012m
(7)R= R=1.8m
R=1.8m
25、解:(1)E的方向向右,A与B碰撞前过程由动能定理得
qEL= mV02 E=
mV02 E=
(2)A和B碰撞过程,根据动量守恒有:
mV0=m(- )+2mVB VB=
)+2mVB VB= V0
V0
B运动到C所用时间:tB= =
=
A运动到C所用的时间,由运动学和动力学公式得
L= tA+
tA+ ?
? ?tA2
?tA2
解得tA= >
>
故A第二次和B相碰,一定是在B和C相碰之后。
(4)
B和C相碰,动量守恒, 2m =4m
=4m +2mVB’
+2mVB’
VB’=0 故W=qEL
26、(16分)(1)①Cu
+ 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O,
CuSO4 + SO2↑+ 2H2O,
2Cu+2H2SO4+O2=2CuSO4+2H2O ②B装置中导气管长进短出
③Na2SO3、Na2SO4、NaOH (2)做实验、查资料、请教老师和别的同学等
(3)①在通入O2之前,用排饱和NaHSO3溶液的方法测出装置A产生气体的体积
②否 用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu2+的蓝色会干扰滴定终点的正确判断
27、(18分)(1)O=C=O
 用作燃气
用作燃气
(2)①2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
②2Fe2++Br2=2Fe3++2Br-
⑤Fe+2Fe3+=3Fe2+
28、(15分)(1)2.1×102 4.5×10-3mol/L (2)碳酸氢根之间的质子传递 (3)酚酞、甲基橙
29、(9分)(1)C4H4 (2)

(3)
30、解析:结合图解分析,掌握调节的方式、原理和过程,结合所学知识,解释有关现象,并进行相关实验探究。要帮助学生总结神经调节与体液调节的区别。实验设计时,要注意去除胃期刺激和长期刺激。
(1)条件反射和非条件反射 运动神经末梢及胃腺 激素调节(体液调节)
(2)血液循环
(3)微碱性环境中使胃蛋白酶失活
(4)将小狗食管切断后喂食,让食物经口腔进入食管后流出体外而不进入胃,观察并分析胃液分泌情况
31、(1)下图

注:①要求标明编码区上游和下游的非编码区,缺一不可;②在编码区上游标出RNA聚合酶结合的位点。
(2)编码区是间隔的、不连续的
(3)DNA(甚因)转录→RNA翻译→伴孢晶体蛋白
(4)①工作量大,具有一定的盲目性 腺嘌呤脱氧核苷酸、鸟嘌呤脱氧核苷酸、胞嘧啶脱氧核苷酸、胸腺嘧啶脱氧核苷酸
 注:严格掌握专用名词的正确书写,有错别字要坚决扣分。
注:严格掌握专用名词的正确书写,有错别字要坚决扣分。
②许多细菌及酵母菌 限制性内切酶 见右图
(5)D
(6)1/4 配子不携带抗虫基因的概率为1/2,受精时,各类型雌雄配子的结合是随机的
(7)叶绿体表现为母系遗传,目的基因不会通过花粉传递给下一代
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com