
题目列表(包括答案和解析)
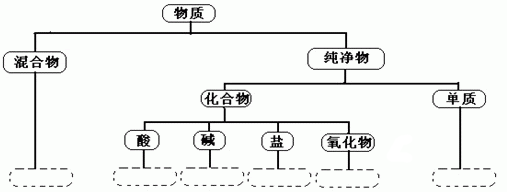
分数是学习和研究物质及其变化的一种常用方法。分数要有一定的标准,如果按照物质的组成对空气、氯酸钾、氮气、烧碱、二氧化锰五种物质进行分类,请将物质的分类结果填写在下面的虚线框内(要求纯净物用化学式表示)
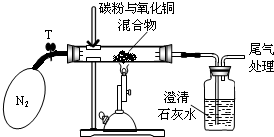 某学习小组对炭粉与氧化铜高温反应产物中气体的成分进行研究.
某学习小组对炭粉与氧化铜高温反应产物中气体的成分进行研究.| 操作步骤及实验现象 | 简答 |
| ①称取8g氧化铜与2g碳粉均匀混合,放入重48.4g的玻璃管中,按上图装置连接 | / |
| ②加热前,先通一段时间纯净、干燥的氮气 | 其目的是 |
| ③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 | 澄清石灰水变浑浊的化学方程式为: |
| ④完全反应后,冷却至室温,称得玻璃管和固体的总质量为56.0g | / |
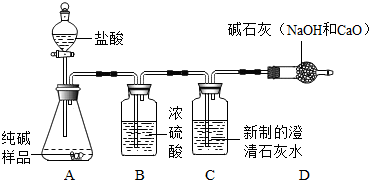
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究。
[设计方案]甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)。装置A中发生反应的化学方程式为 ,洗气瓶B中浓硫酸的作用为
[实验探究]当玻璃管中固体由黑色转变为红色时,实验测得:①装置C的玻璃管和其中固体的总质量在反应后减少了1.6g;②装置D的干燥管和其中物质的总质量在反应后增加了1.82g,用此数据算得水中H、O元素的质量比为 ,而由水的化学式算得H、O元素的质量比为 。
[分析交流]针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是 (假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计)。小组同学用改进后的装置重新实验得到了正确结果。
[意外发现]丙同学不小心将反应后的少量红色固体a洒落到多量稀硫酸中了,发现除了有红色固体b以外,溶液的颜色由无色变为蓝色。
[提出问题]铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢?
[查阅资料]①CuO被还原的过程中会有Cu2O生成,Cu2O也能被还原在Cu;
②Cu2O固体是红色的,它一稀硫酸的反应为:
Cu2O+H2SO4=CuSO4+Cu+H2O.
[得出结论]红色固体a中含有Cu2O。
[分析交流]红色固体a中含有Cu2O是否会影响水组成的测定结果 (填“影响”或“不影响”)。
[提出猜想]针对红色固体a的成分,小组同学提出猜想①是:Cu2O和Cu;猜想②是: 。
[拓展探究]丁同学利用改进后的装置及药品重新实验,通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,你认为他还需要称量 的质量。
[教师点拨]称取一定质量的红色固体a与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立。
[定量分析]小组同学再次实验,他们开始称取质量为3.6g的红色固体a,与足量的稀硫酸完全反应后得到红色固体b为2g 。假如3.6g红色固体a都是Cu2O,请你计算出生成铜的质量(利用Cu2O+H2SO4=CuSO4+Cu+H2O.进行计算,写出计算过程);然后,通过与实际得到的固体2g进行比较,判断猜想 成立(填①或②)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com