某学习小组的同学在学习了Na
2CO
3、NaHCO
3的性质后,了解到它们都能与盐酸反应产
生CO
2气体,那么如何鉴别Na
2CO
3和NaHCO
3呢?带着这样的疑问,他们进行了下列探究:
【查阅资料】
(1)Ca(HCO
3)
2可溶于水;
(2)NaHCO
3固体受热分解生成碳酸钠、二氧化碳和水.
【猜想】
(1)甲同学认为可用澄清石灰水鉴别Na
2CO
3和NaHCO
3溶液.
(2)乙同学认为可用CaCl
2溶液鉴别Na
2CO
3和NaHCO
3溶液.
甲、乙两同学的猜想是依据澄清石灰水、CaCl
2溶液分别与Na
2CO
3溶液反应均有沉淀产生;又知道Ca(HCO
3)
2可溶于水,因此猜测澄清石灰水、CaCl
2溶液分别与NaHCO
3溶液混合不会产生沉淀,从而鉴别出两种溶液.
(3)丙同学认为固体Na
2CO
3、NaHCO
3可用加热的方法鉴别.
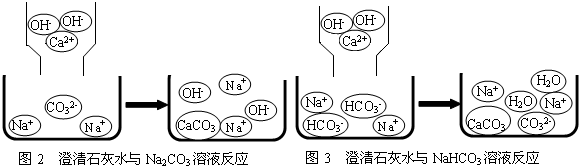
【实验探究】(1)甲同学在两支分别盛有少量Na
2CO
3、NaHCO
3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na
2CO
3和NaHCO
3溶液.
(2)乙同学将CaCl
2溶液加入到分别盛有少量Na
2CO
3、NaHCO
3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果
出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl
2溶液鉴别Na
2CO
3和NaHCO
3溶液.
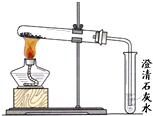
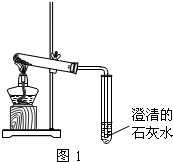
(3)丙同学分别取了一定量的Na
2CO
3、NaHCO
3固体于大试管中加热(如图3所示):
①加热Na
2CO
3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO
3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
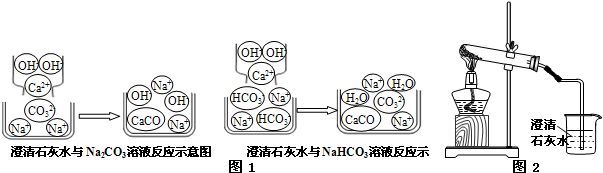
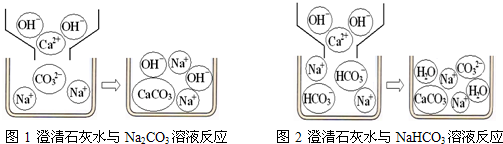
【问题讨论】(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图1、图2).请写出Na
2CO
3与澄清石灰水发生反应的化学方程式
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
;写出NaHCO
3与澄清石灰水混合时参与反应的离子:
Ca2+、OH-、HCO3-
Ca2+、OH-、HCO3-
.
(2)乙同学的两个实验中,大家对CaCl
2与Na
2CO
3溶液的反应比较熟悉,而对CaCl
2与NaHCO
3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl
2与NaHCO
3溶液可发生如下反应:CaCl
2+2NaHCO
3=CaCO
3↓+2NaCl+CO
2↑+H
2O,因而同学们知道了乙同学是通过观察到
气泡产生
气泡产生
现象来鉴别Na
2CO
3和NaHCO
3溶液的.至于CaCl
2与NaHCO
3溶液为什么能发生上述反应,老师指出其反应原理较复杂,有待于今后学习中进一步探究.
(3)丙同学在加热Na
2CO
3固体时,开始产生少量气泡的原因是
试管中的空气受热体积膨胀
试管中的空气受热体积膨胀
;根据你分析:Na
2CO
3受热
不易
不易
分解(填“易”或“不易”).在加热NaHCO
3固体时,丙同学观察到的实验现象是
澄清石灰水变浑浊
澄清石灰水变浑浊
(任写一种).
【拓展应用】(1)固体Na
2CO
3中混有少量NaHCO
3,可通过
加热
加热
方法除去.
(2)把105g氯化钙溶液与100g5.3%的碳酸钠溶液混合,恰好完全反应,则反应所得溶液中溶质的质量分数是多少?(写出完整的解题过程).


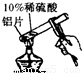
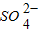 能否促进铝和硫酸的反应?
能否促进铝和硫酸的反应?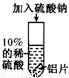
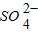 以及Na+对反应无影响
以及Na+对反应无影响 ______
______
 能否促进铝和硫酸的反应?
能否促进铝和硫酸的反应?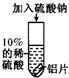
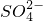 以及Na+对反应无影响
以及Na+对反应无影响 ______
______
 生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究: