(2013?册亨县模拟)(1)某试验小组在研究二氧化碳的性质时,利用如图所示试验装置进行试验.回答下列问题.
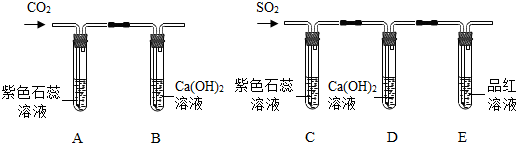
A中的现象是
溶液变红
溶液变红
;
B中反应的化学方程式是
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
.
(2)该小组利用对比的方法研究二氧化硫的性质,进行如下探究.
【提出问题】二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与某些有色物质(如品红溶液)反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在.
【试验探究】试验装置如图所示.
①装置C中紫色石蕊溶液变红,是由于二氧化硫与水反应生成了亚硫酸(H
2SO
3);装置D中澄清石灰水变浑浊,该反应的化学方程式是
SO2+Ca(OH)2=CaSO3↓+H2O
SO2+Ca(OH)2=CaSO3↓+H2O
.
②装置E的试管中溶液变无色,取该溶液加热,溶液又变为无色,其原因是
二氧化硫与品红溶液反应生成不稳定的无色物质,加热又分解生成了品红
二氧化硫与品红溶液反应生成不稳定的无色物质,加热又分解生成了品红
.
③此装置有一个明显的不足之处是
没有进行尾气处理
没有进行尾气处理
.
④活性炭也能使品红溶液褪色,其褪色原理与二氧化硫使品红溶液褪色的原理不相同,其理由
活性炭的吸附过程是物理变化,而二氧化硫使溶液褪色是化学变化
活性炭的吸附过程是物理变化,而二氧化硫使溶液褪色是化学变化
【反思提高】某同学将二氧化硫通入到紫色的酸性高锰酸钾溶液中,观察到溶液由紫色变为无色,由此他得出的结论是:二氧化硫能将酸性高锰酸钾溶液漂白.请你设计试验证明此结论是否正确(要求写出操作、现象、结论)
将褪色后的溶液加热,观察溶液颜色变化,若溶液恢复为红色,则此结论是正确的;若溶液不能恢复为红色,则此结论不正确
将褪色后的溶液加热,观察溶液颜色变化,若溶液恢复为红色,则此结论是正确的;若溶液不能恢复为红色,则此结论不正确
.
【试验结论】二氧化硫与二氧化碳有相似的化学性质,但二氧化硫还具有某些特殊的化学性质.

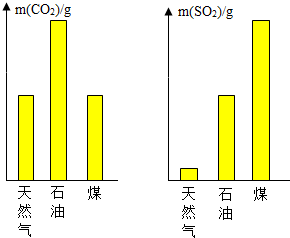 “生活中处处有化学”.请你用所学知识结合生活经验回答下列问题:
“生活中处处有化学”.请你用所学知识结合生活经验回答下列问题:
 (2013?虹口区二模)人类生存离不开空气.
(2013?虹口区二模)人类生存离不开空气.