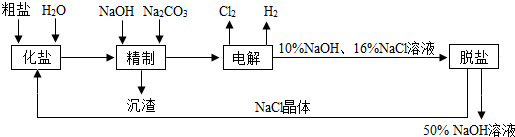
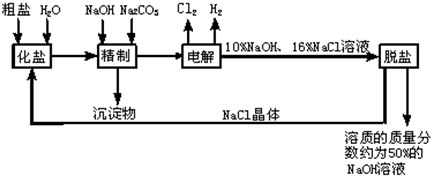
(2012?泉州模拟)在初三化学实验复习课上,老师提供了三瓶无色溶液,其中一瓶是稀盐酸,另外两瓶没有贴标签,分别是碳酸钠溶液和氢氧化钠溶液.
复习内容一:鉴别两瓶没有贴标签无色溶液
同学们设计了实验方案,分别取样于试管a、b两支试管中,再进行如图所示的实验操作.
(1)观察有1支试管中有
气泡
气泡
产生,证明该溶液是碳酸钠溶液.
(2)写出试管a或b中发生反应的化学方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
(写一个即可).实验结束后,老师要求同学们把鉴别后所得的溶液倒入盛回收液的A烧杯或B烧杯中.
复习内容二:探究回收液中,影响溶液酸碱性的溶质成分
(3)小明同学取少量A烧杯的回收液,滴入紫色石蕊试液,石蕊试液变红,从而证明A烧杯的回收液呈
酸
酸
性.根据实验结果,你认为A烧杯的回收液中必含有的溶质是
HCl、NaCl
HCl、NaCl
.
(4)小影同学用玻璃棒蘸取B烧杯中的回收液滴在 pH试纸上,测得pH=9,证明B烧杯中的回收液呈
碱
碱
性.根据实验结果,小影猜想B烧杯回收液中可能含有的溶质是:①氢氧化钠;②碳酸钠;③氢氧化钠和碳酸钠.
【查阅资料】CaCl
2溶液呈中性,可与碳酸钠溶液发生如下反应:Na
2CO
3+CaCl
2=2NaCl+CaCO
3↓
【查阅资料】
| 实验步骤 |
实验现象 |
实验结论 |
| Ⅰ.取少量B烧杯中的回收液于试管中,滴入饱和氢氧化钙溶液. |
产生白色沉淀 |
B烧杯中的回收液中含有 碳酸钠 碳酸钠 |
| Ⅱ.①另取少量B烧杯中的回收液于试管中,滴入足量的 CaCl2 CaCl2 溶液.
②过滤,往滤液中滴加酚酞试液 酚酞试液 |
①产生白色沉淀.
②酚酞变红色(或无变化) 酚酞变红色(或无变化) |
B烧杯中的回收液中
有氢氧化钠(或没有氢氧化钠) 有氢氧化钠(或没有氢氧化钠) |
(5)综合上述实验Ⅰ、Ⅱ的结果:你认为小影同学的猜想
③(或②)
③(或②)
是正确的.
【能力提升】
(6)老师把A、B两烧杯中的回收液混合在一起,并测得混合液的pH=4,要求同学们选择下列其中一种试剂,通过加入过量的该试剂,以调节废液的pH=7,你认为他们应选择
C
C
(填标号).
A.Ca(OH)
2 B.CaO C.CaCO
3 D.H
2SO
4.

 如图所示,锥形瓶中盛有气体X,胶头滴管中盛有液体Y.若挤压胶头滴管使液体滴入瓶中,振荡一段时间后可见小气球a膨胀鼓起.下列各组X、Y物质不会出现上述现象的是( )
如图所示,锥形瓶中盛有气体X,胶头滴管中盛有液体Y.若挤压胶头滴管使液体滴入瓶中,振荡一段时间后可见小气球a膨胀鼓起.下列各组X、Y物质不会出现上述现象的是( ) (2012?泉州模拟)在初三化学实验复习课上,老师提供了三瓶无色溶液,其中一瓶是稀盐酸,另外两瓶没有贴标签,分别是碳酸钠溶液和氢氧化钠溶液.
(2012?泉州模拟)在初三化学实验复习课上,老师提供了三瓶无色溶液,其中一瓶是稀盐酸,另外两瓶没有贴标签,分别是碳酸钠溶液和氢氧化钠溶液.