
题目列表(包括答案和解析)

某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。为了测定该石灰石的纯度,该研究性学习小组取用4g这种石灰石样品,用实验室现有稀盐酸40g分4次加入。每次充分反应后,经过滤、干燥等操作。操作后称量固体物质的质量。每次稀盐酸的用量及剩余固体的质量见下表。(假设过滤、干燥等操作过程,固体物质不受损耗)
计算:
(1)该石灰石样品的纯度是多少?
(2)第三次产生的二氧化碳的质量是多少?
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入1Og | 3.Og |
| 第二次加入1Og | 2. Og |
| . 第三次加入10g | 1. Og |
| 第四次加入10g | O.4g |
| 某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。为了测定该石灰石的纯度,该研究性学习小组取用4g这种石灰石样品,用实验室现有稀盐酸40g分4次加入。每次充分反应后,经过滤、干燥等操作。操作后称量固体物质的质量。每次稀盐酸的用量及剩余固体的质量见下表。(假设过滤、干燥等操作过程,固体物质不受损耗) | ||||||||||
| ||||||||||
| 计算: (1)该石灰石样品的纯度是多少? (2)三、四次产生的二氧化碳的质量共为多少? |
CaCO3广泛存在于自然界,是一种重要的化工原料。某种大理石除主要成分为CaCO3外,还有少量的硫化物。小平和小明同学用这种大理石和稀盐酸反应,分别开展以下探究,请你参与探究并回答相关问题。
【查阅资料】资料一:在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。下列反应均能发生,其中不符合该规律的是 (填字母)
资料二:CuS是黑褐色无定形粉末或粒状物,不溶于浓盐酸,不溶于水和硫化钠溶液。
【实验探究】小平同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:
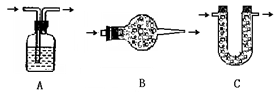
图2
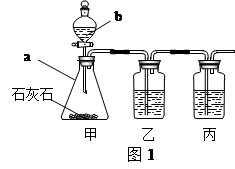
【制取CO2】利用图1、与图2干燥装置制得纯净干燥的CO2。
(1)仪器a的名称是 ,仪器b的名称是 。
装置甲中主要反应的化学方程式为 。
(2)装置丙盛有足量的饱和NaHCO3溶液,目的是除去 。
装置丙中主要反应的化学方程式为 。
装置乙中盛有的物质是 溶液。现象: 。
(3)利用图2干燥装置干燥气体,常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰,若选用A装置,则A装置中放入药品 (选择序号);
若选用B装置,则B装置中放入药品 (选择序号)。
(4)小明同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验: 
小明同学通过分析计算,得出结论:该实验中生成的二氧化碳的质量是4.4g。大理石样品纯度为83.3%。请你评价他的结论是否正确 __,并简述理由____ _____。




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com