
题目列表(包括答案和解析)
 氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2.
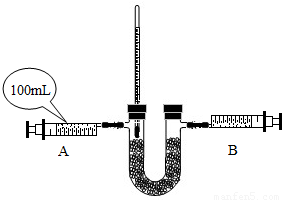
氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2.| 时间/s | 0 | 60 | 120 | 180 | 240 | 300 |
| 天平示数/g | 85.00 | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |

| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
| 时间/s | 60 | 120 | 180 | 240 | 300 | |
| 天平示数/g | 85.00 | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com