
题目列表(包括答案和解析)
(本题共12分)
已知:
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
 根据题意完成下列填空:
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品
在右图装置的圆底烧瓶中依次加入NaBr,10 mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
(1)写出制备1-溴丁烷的化学反应方程式:
__________________________________________________
(2)反应装置中加入沸石的目的是__________________。
配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3)反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
 (二)制备精品
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按右图装置蒸馏。
(5)收集产品时,控制的温度应在_________℃左右;
区分1-溴丁烷精品和粗品的一种方法是____________________。
(6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。
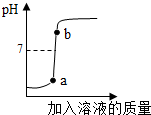 (2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.
(2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.| 80 |
| 98 |
| 80g×5% |
| X |
| 4.9g |
| 50g |
| 80 |
| 98 |
| 80g×5% |
| X |
| 4.9g |
| 50g |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com