
题目列表(包括答案和解析)
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
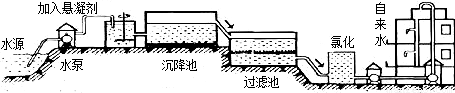
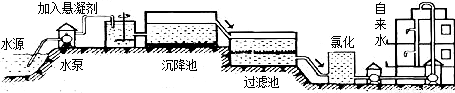
(1)自来水的生产过程大体如下图:
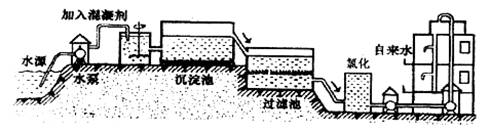
上图过滤池中有活性炭层,该过程中发生 变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制![]() 溶液时不宜使用自来水,其原因是(用化学方程式表示) 。高锰酸钾(
溶液时不宜使用自来水,其原因是(用化学方程式表示) 。高锰酸钾(![]() )是一种理想的水处理剂,高铁酸钾中铁元素的化合价是 。
)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是 。
(2)电解水时,加入少量![]() 可以增强水的导电性。现将0.1g
可以增强水的导电性。现将0.1g![]() 溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是 ,当溶液中
溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是 ,当溶液中![]() 的质量分数变为0.2%时,有 水被分解。
的质量分数变为0.2%时,有 水被分解。
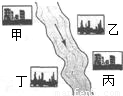
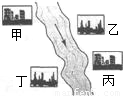
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有![]() 、
、![]() 、
、![]() 、
、![]() 中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
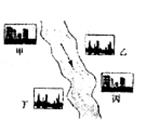
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是 。
②乙处河水呈红褐色的化学方程式是 。
③丁处产生气泡的化学方程式是 。
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.
(1)
自来水的生产过程大体如图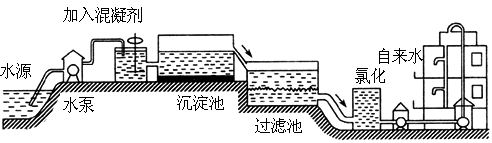
上图过滤池中有活性炭层,活性炭起
________作用,该过程中发生________变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸,写出氯气与水发生反应的文字表达式:________.(2)
电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在917.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是________,当溶液中NaOH的质量分数变为0.2%时,有________水被分解.(3)
保护水资源,我们应该采取的措施是______________________.
 HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:一、选择题(本题20分)每题只有一个正确答案,将其标号填在下表中。每题2分。
题号
1
2
3
4
5
6
7
8
9
10
答案
B
B
C
C
D
C
D
B
A
C
二、选择题(本题共10分)每题有1~2个正确答案,将其标号填在下表中。每题2分。正确答案只有一个选项的,多选不给分;正确答案包括两个选项的只选一个且正确给1分,一对一错不给分。
题号
11
12
13
14
15
答案
BD
A
AC
B
C
三、(本大题共6题 共15分)
16.(4分)每空1分。(1)NaCl (2)+5 (3)醋酸 (4)CH4
 17.(2分)每空1分。(1)分子在永不停息的做着无规则运动(2)分子间有间隙
17.(2分)每空1分。(1)分子在永不停息的做着无规则运动(2)分子间有间隙
18.(4分)每空1分。2Cl 2O2 2Fe2+ Ca
19.(1分)每空1分。0.3%
20.(2分)每空1分。30 120
21.(2分)每空1分。(1)34(2)C
22.(4分)每空1分。 2Mg+O2=====2MgO ;2KMnO4===== K2MnO4+MnO2+O2↑;
Mg+2HCl=====MgCl2+H2↑;Fe(OH)3+3HCl=====FeCl3+3H2O
23.(4分)每空1分。(1)A (2)b 升高温度 加水
24.(7分)每空1分。不成立;成立;不成立;产生白色沉淀;每种物质1分,NaOH
Na2CO3
五、(本大题共2题 共14分)
25.(9)每空1分。(1)每种物质1分, NH3;SO2 H2S (2)①木炭 ②氧化铜 ③铜
(3)CaO+H2O===Ca(OH)2;Na2CO3+Ca(OH)2== CaCO3↓+ 2NaOH;DEF
26.(5分)每空1分。A CH4; C CO2; D CO; 甲 O2; 乙 H2
六、(本大题共3题 共16分)
27.(3分)每空1分。A HCl 或MgCl2 ;B Na2SO4 ;C CaCl2 或HCl
28.(8分)每空1分。(1)吸附;物理 AgNO3+HCl===AgCl↓+HNO3(2)O2;50
(3)①酚酞试液,其他合理答案均给分。②FeCl3+3NaOH===Fe(OH)3↓+3NaCl
③Na2CO3+2HCl===2NaCl+H2O+CO2↑
29.(5分)①每种物质1分。C CuO Fe2O3
②每种物质检验的实验步骤,实验现象,结论正确1分。其他合理答案均给分。
实验步骤
实验现象
得出结论
取原混合物加入足的稀硝酸
若产生气泡
原混合物含有碳酸钙
若无气泡产生
原混合物不含有碳酸钙
向上述反应后的溶液中加入硝酸银溶液
若产生沉淀
原混合物含有氯化钠
若无沉淀产生
原混合物不含有氯化钠
七、计算题(本大题共2题 共10分)
30.(4分)解:
氧化铁的质量为8000┧×(1―20%)=6400┧ …………1分
|