
 ②
;
②
;
(2)右图是NaOH滴定磷酸的pH变化曲线图,已知曲线右端NaOH已过量。
①写出第一次滴定突跃前反应的离子方程式
;
②你认为曲线中没有第三个突跃的可能原因是:
A.磷酸是二元酸,只有二个突跃
B.到第二个突跃后,溶液碱性已较强,滴定过程中溶液碱性变化不大了
C.磷酸浓度不够大,不能出现第三个突跃
D.NaOH溶液量不足,在第三个突跃前已消耗完
E.第三次滴定突跃范围太窄,不明显
 Ⅱ(2)DIS数字化信息系统因为可以准确测量溶液的pH而在中和滴定的研究中应用越来越广泛深入。某学习小组利用DIS系统测定NaOH滴定同浓度HCl、CH3COOH的pH变化曲线分别如下,你能从中得到的信息有(写出2条信息):
Ⅱ(2)DIS数字化信息系统因为可以准确测量溶液的pH而在中和滴定的研究中应用越来越广泛深入。某学习小组利用DIS系统测定NaOH滴定同浓度HCl、CH3COOH的pH变化曲线分别如下,你能从中得到的信息有(写出2条信息):
① ;
19.08mL
18.15mL
19.12mL
0.10mL
(3)已知标准NaOH溶液的浓度为0.1000 mol?L-1,所取待测醋酸的体积V均为20.00mL。实验过程记录的数据如下表,求待测醋酸的物质的量浓度 。
滴定前
第一次终点
第二次终点
第三次终点
碱式滴定管
液面刻度
28.(14分)滴定分析法又叫容量分析法,是一种重要的定量分析方法。这种方法是将一种已知准确浓度的试剂通过滴定管滴加到被测物质的溶液中,直到所加试剂与被测物质恰好完全反应,然后求出被测物质的组分含量。酸碱中和滴定是重要的滴定分析实验。
I(1)现用已知浓度的NaOH溶液,用中和滴定法去测定未知浓度的CH3COOH溶液,实验步骤如下,请填写有关内容:
①将酸式滴定管洗净后,每次用3-4mL待测醋酸溶液润洗2-3次,然后加入待测醋酸至0刻度以上。把滴定管夹在滴定管夹上,转动活塞,放出少量溶液,使滴定管
,并使液面达到 ,记录初读数。
②用相似的方法在碱式滴定管中加入标准NaOH溶液,并调节好液面。
③在酸式滴定管内取VmL的待测醋酸移到洗净的锥形瓶中,加2-3滴 作指示剂,记录终读数。
④用标准NaOH溶液滴定待测醋酸。左手 ,向锥形瓶中慢慢滴加NaOH溶液,右手轻轻摇动锥形瓶,两眼注视 ,当溶液颜色由无色变为粉红色,且半分钟内不褪色,表示达到滴定终点,记录终读数。
⑤重复上述实验步骤。
(2)指示剂的选择一般根据滴定突跃,其选择标准是: 。
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为
,升高温度后,反应2NO2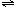 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol?L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
0.08
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol?(L?s)-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com