
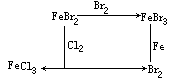
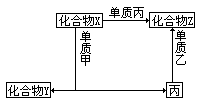
答案:(1)X:二氧化碳;Z:一氧化碳;Y:氧化镁
甲:镁;乙:氧气;丙:碳(化学方程式从略)。
(2)X:溴化铁;Y:氯化亚铁;Z:溴化铁;
甲:氯气;乙:铁;丙:溴。(化学方程式从略)
【投影】有 A、B、C、D、E五种金属。已知:①E的氧化产物比D的氧化产物氧化能力强;②A投入E的盐溶液中可得E单质;③在以A、D为极板形成的原电池中,D极上发生还原反应;④电解含有A、B、C、E离子的盐溶液时,B离子最先在电极上放电,其次是
E离子,而A、C离子则不能在电极上放电;⑤C的碳酸盐的溶解度大于它的酸式碳酸盐。推出五种金属的活动顺序是______。
判断金属活动性强弱顺序,也就是判断出金属在反应中失去电子的难易。可以根据金属活动性顺序和金属元素在周期表中位置结合试题进行分析、判断。
由①:氧化性E离子>D离子,说明金属性D>E。
由②:A能从盐溶液置换出E,说明金属性A>E。
由③:根据原电池工作原理,活泼金属为负极,发生氧化反应;不活泼金属为正极,发生还原反应,说明A>D。
由④:根据金属离子在溶液中放电顺序一般恰好与金属活动性顺序相反,说明金属性强弱A(或C)>E>B。
由⑤:只有碱金属元素才具有碳酸盐的溶解度大于相应酸式碳酸盐的溶解度。
总结分析,金属的活动性顺序为:C>A>D>E>B。
【答案】C>A>D>E>B。
【小结】本节只对金属单质化学性质规律进行了总结,不同的金属特性,将在以后的课中复习。
【板书】四、金属的冶炼
【提问】什么是金属的冶炼?其本质上是怎样的一个过程?
引导学生分析,回答,并进行笔记整理(见右侧内容)。
原理:将金属化合物或矿石通过还原反应的方法使金属阳离子还原成金属单质的过程。

由于单质丙的不一致性,后者可以删去,答案只有前者。
④若甲为非金属,乙为金属,能形成X与甲置换关系的只有:
NO
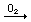 NO2等。
NO2等。
③若甲为金属,乙为非金属,能形成X与甲置换关系的可能有:
FeCl3
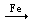 FeCl2; SO2
FeCl2; SO2 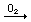 SO3;
SO3;
FeBr2
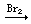 FeBr3; FeCl2
FeBr3; FeCl2 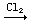 FeCl3;
FeCl3;
CO2
 CO;
CO;
(1)若单质甲为金属,单质乙为非金属,指出它们的物质名称,并写出有关反应的化学方程式。
(2)若单质甲为非金属,单质乙为金属,指出它们的物质名称,并写出有关反应的化学方程式。
分析、讨论:
①X+甲→Y+丙,是置换反应。
②X与Z都是含Z、丙两种元素的化合物,则:X+丙→Z,为相同元素的不同价态的转化,可以考虑下列化合物转化的有:
回答:(1)4.5g?cm-3,Cu、Hg、Ag、Pb、Ba
(2)黑色金属
(3)Hg、Cr
【讲述】金属原子易失去价电子成为阳离子,因而表现出较强的还原性。由于不同的金属原子结构、原子半径的不同,表现的还原性也有强弱不同。
【提问】请写出金属活动性顺序,并按它们的活动性顺序把有关反应的难易条件总结出来。
(指导学生讨论回答,并填表整理)
讨论回答(并列表投影展示)
金属活动性顺序:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au
金属活动性(还原性):由强→弱
与O2:
与Cl2:
与水:
与酸:
与盐:
【投影】下图表示物质之间的相互转化关系:
2.金属的物理性质
【讲述】金属都具有金属光泽、良好的导电、导热性和延展性。而密度、颜色、硬度、熔点等,不同金属之间存在一定的差别。
【投影】
例题2 判断、填空题:
(1)金属可分为重金属和轻金属,其中密度大于______的叫做重金属,如(举5种)_______。
(2)金属又可分为黑色金属和有色金属,其中Fe、Cr、Mn常称为______。
(3)在金属中,熔点最低的是______,硬度最大的是______。
引导学生思考、回答。

【投影】
例题1 下列说法正确吗?为什么?
(1)含有金属阳离子的晶体一定含有阴离子。
(2)在离子晶体中既有阴离子,又有金属阳离子。
(3)离子晶体的化合物其熔点一定高于金属晶体。
引导学生思考、回答。
回答:(1)不正确。在金属晶体内就不存在阴离子。
(2)不正确。由铵根离子形成的离子晶体所含的阳离子不是金属阳离子。
(3)不正确。不同金属晶体熔点高低有的相差较大,如钨的熔点3410℃,而离子晶体的熔点一般在800℃左右。
【板书】
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com