
6.已知短周期元素的离子aA2+、bB+、cC3―、dD―都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子序数d<c<b<a B.原子半径A>B>C>D
C.离子半径C>D>B>A D.单质的还原性A>B>D>C
5.英国研究人员
A.砷原子序数为33,它与铝为同主族 B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强 D.砷酸的酸性比硫酸的弱
4.核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数为(2n2-1)。下列关于元素X的说法中,不正确的是( )
A.其最高化合价为+3价 B.可以形成化学式为KXO3的盐
C.其氢化物可以用来做喷泉实验 D.其最高价氧化物的水化物是强酸
3.下列描述中,不正确的是 ( )
A.14N与15N具有相同的质子数 B.18O和17O具有相同的电子数
C.18O与
C. 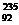 U与
U与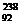 U互为同素异形体 D.
U互为同素异形体 D. 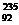 U原子核内中子数为143,核外电子数为92
U原子核内中子数为143,核外电子数为92
A. 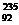 U不具有放射性
B.铀元素的相对原子质量为235
U不具有放射性
B.铀元素的相对原子质量为235
2.伊朗核问题已引起国际社会的普遍关注,所谓浓缩铀就是提取一定浓度的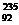 U,下列有关
U,下列有关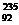 U的说法中,正确的是( )
U的说法中,正确的是( )
1.
A.3He和4He两种核素互为同素异形体
B.3He和4He两种核素互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应
D.在3He中存在:质子数=中子数=核外电子数
13.(2006年四川卷)在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强相等 B. O2比03的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
【高考说明】
①了解元素、核素和同位素的含义。
②了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。了解原子、离子等概念的含义
③了解原子核外电子排布。
④掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
⑥以ⅠA和ⅦA族为例,掌握同一主族内元素性质的递变规律与原子结构的关系。
⑦了解金属、非金属在元素周期表中的位置及其性质递变的规律。
⑧了解化学键的定义。了解离子键、共价键的形成。
⑨了解分子的含义。了解原子团的含义
⑩了解物质的组成、结构和性质的关系
【典型例题】
D.一定温度下,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com