
18、(8分)坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
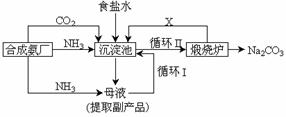
①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出 C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
17、(10分)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-和NO3-的质量比约为4.13∶1,NO3-的比例呈明显上升的趋势。
回答下列问题:
(1)江苏省大气污染特征是( )
A.煤烟型 B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D. 由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)请你提出江苏省防治酸雨的两条主要措施
; 。
(3)某校研究性学习小组拟选择 “不同地点空气中二氧化硫的含量分析”的课题进行探究。
① 如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别是
② 通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是___________。
③ 甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
HCHO + H2SO3
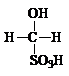
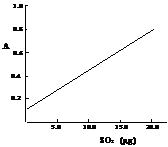 该反应类型属于 。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量。实验测得SO2含量与溶液的吸光度A的关系如右图所示。若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为________________
_______。
该反应类型属于 。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量。实验测得SO2含量与溶液的吸光度A的关系如右图所示。若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为________________
_______。
16、(10分) A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属。请回答下列问题:
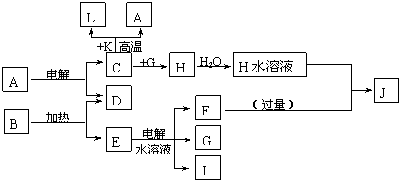 (1)若K为红棕色粉末,写出C与K反应的化学方程式____________________________,引发该反应的操作为___________________________________________________________。
(1)若K为红棕色粉末,写出C与K反应的化学方程式____________________________,引发该反应的操作为___________________________________________________________。
(2)写出电解E水溶液的化学方程式__________________________________________。
(3)J与H反应的离子方程式为_________________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。
15、(18分)某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1-2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1).此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式___________、____________。
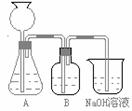 此方案第一步的实验装置如右图所示:
此方案第一步的实验装置如右图所示:
(2).加入反应物前,如何检查整个装置的气密性: ___________________________________________ _____.
(3).装置B中盛放的试剂是______________,作用是_________________。
(4).在实验室通常制法中,装置A还可作为下列________________气体的发生装置(填序号).
①CH2==CH2 ②NH3 ③ O2 ④ H2
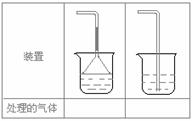 (5).实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
(5).实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
(6).已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________.
14、下述实验能达到预期目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
向某无色溶液中滴加酚酞试液 |
确定该溶液为碱溶液 |
2009-2010学年第一学期高三年级月考试卷
第II卷 非选择题(共72分)
13、将铜片放入稀硫酸中不会溶解,加入下列物质后能使铜溶解的是
A.NaNO3 B. FeCl3 C.浓HCl D.AlCl3
12、研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是 ( )
A.密闭容器中CuO和C高温反应的气体产物: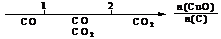
B.Fe在Cl2中的燃烧产物: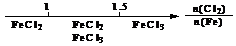
C.AlCl3溶液中滴加NaOH后铝的存在形式: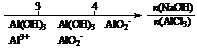
D.氨水与SO2反应后溶液中的铵盐: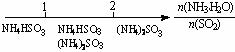
11、下列各组物质中,不能按 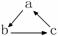 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
|
选项 |
A |
B |
C |
D |
|
a |
NaOH |
HNO3 |
HCl |
S |
|
b |
Na2CO3 |
NO |
Cl2 |
SO3 |
|
c |
NaCl |
NO2 |
HClO |
H2SO4 |
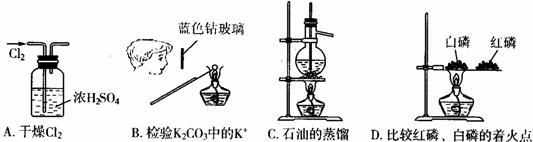
10、用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的的是( )
9、阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是
A.标准状况下,2.24 L苯中约含有3.612×1023个碳原子
B.常温常压下,氧气和臭氧的混合物16 g中约含有6.02×1023个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×1023个氢氧根离子
D.0.5mol CH4中约含有3.01×1024个电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com