
2. 24
24







 1.12
1.12
0 0.01 0.02 0.03 0.04 0.05 0.06 a
[解析]这是一道综合题,题中涉及了混合物反应的计算,过量问题的计算、计算推断、数据缺省型的计算、范围讨论计算及数形结合计算等。
答案:(1)略。由表中数据分析可知第一份、第二份样品进行实验时H2SO4足量,从而求算得出(2)C和(3)n(Na2S2O3):n(Na2SO3):n(Na2SO4)=4:1:1.
(4)由表中数据分析可知第三份实验中H2SO4量不足,求出C(H2SO4)=5.0mol/L。
(5)m样品/m1=63g/12.60g=5,因此63g样品中含Na2S203 0.2mol, Na2S03和Na2S04各0.05mol,H2SO4与之恰好完全反应时需0.25mol,体积为0.05L。因此当0<a<0.05L时,b=V(SO2)=112aL 当a≥0.05L时,b=V(SO2)=5.6L
图象为
b(L)
3. 36
36
4. 48
48
5. 60
60
6. 72
72
19. Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S=Na2S203,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3•5H2O晶体析出,该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。
为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 ;
(2)根据上表数据分析,该样品 (填选项字母);
A、只含有Na2S203
B、含有Na2S203和Na2S03
C、含有Na2S203 、Na2S03,和Na2S04三种成分
(3)试计算,该样品中各成分的物质的量之比?
(4)所加硫酸溶液的物质的量浓度为 ;
(5)若将63g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位) ;
试讨论:当a在不同取值范围时,SO2的体积b,并请在下图中画出b随a的变化的曲线。
b(L)
18. 已知Cl-与Ag+,每次新生成的AgCl中又有10%见光分解成单质和Cl2,Cl2又可在水溶液中歧化成HClO3和HCl,而这样形成的Cl-又与剩余的Ag+作用生成沉淀,这样循环往复,直到最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3。求最终能生成多少克难溶物(Ag和AgCl)?若最后溶液体积为1L,求C(H+)为多少?
[解析]此题为运用数列知识解决化学问题的试题。发生反应为
Ag++Cl-=AgCl↓,2AgCl===2Ag+Cl2,3Cl2+3H2O=HClO3+5HCl由题意可知n(AgCl):n(Ag)=9:1,由2AgCl--Cl2--1/3HClO可知1molAgCl可转化为HClO31/6mol,因此n(AgCl):n(Ag):n(HClO3)=9:1:1/6=54:6:1,总反应方程式为
60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+,从而求出m(难溶物)=167.94g,C(H+)=0.12mol/L
17. 有不同浓度的NaOH溶液各取100mL分别通入SO2 1.12L(标况),完全反应后,分别得到不含结晶水的固体6.00g和7.00g,求这两种溶液的不同浓度值(mol/L)?
分析:SO2与NaOH溶液反应,可能有三种情况:NaOH过量,所得固体为Na2SO3和NaOH的混合物;SO2部分过量,所得固体为Na2SO3和NaHSO3的混合物;SO2极大过量所得固体为NaHSO3,因此本题应首先确定固体的成分。
(1)应用极值法先确定两个极值
a:设SO2与NaOH完全作用生成Na2SO3
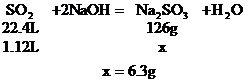
b:设SO2极大过量,最终产物为NaHSO3
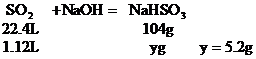
(2)讨论确定产物
a:因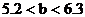 ,所以b g固体为Na2SO3和NaHSO3的混合物
,所以b g固体为Na2SO3和NaHSO3的混合物
b:因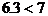 所以7 g固体为Na2SO3和NaOH的混合物
所以7 g固体为Na2SO3和NaOH的混合物
(3)计算
a:第一种情况,设生成Na2SO3为xmol,NaHSO3为ymol
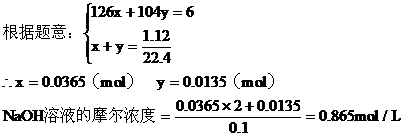
b:第二种情况:因NaOH过量,所以H2SO2完全反应。设参加反应的NaOH为amol,生成Na2SO3为bmol,过量的NaOH为Cmol
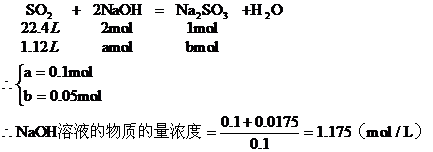
16. 饱和烃A和不饱和烃B在常温下均为气体,其中A含C原子数多于B。
(1)将A、B按一定比例混合。1L混合气完全燃烧后在同温、同压下得到3.6L CO2。试推断该混合气的可能组合及A、B混合时的体积比。将结果填入下表。
|
A的分子式 |
B的分子式 |
VA∶VB |
|
|
|
|
(2)1mol该混合气体恰好能使含0.4mol溴的CCl4溶液完全褪色,推断上述组合中符合该条件的A与B的分子式并填入下表
|
A的分子式 |
|
|
|
B的分子式 |
|
|
分析:(1)本题是用计算推理方法确定混合烃的组成。1L碳原子数为n的烷烃或烯烃充分燃烧均得到nL CO2。由题意推断,该混合烃只能由碳原子数大于3.6的烷烃和碳原子数小于3.6的烯烃或炔烃组成。它们可能有四种组合,根据每种组合中烷烃和不饱和烃的碳原子数及燃烧后生成CO2的体积可能有四种组合,根据每种组合中烷烃和不饱和烃的碳原子数及燃烧后生成CO2的体积可确定A和B的体积比。例如:若A为C4H10,B为C2H4。设1升混合气中含C4H10为x L,含C2H4为(1-x)L,它们充分燃烧后分别得到4x升CO2和2(1-x)L CO2,根据1升混合气燃烧后得到3.6LCO2,可得4x+2(1-x)=3.6
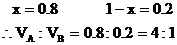
也可用十字交叉来解:
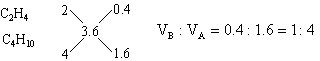
其它组合可依此类推,于是得到:
|
组合的编号 |
A的分子式 |
B的分子式 |
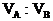 |
|
① |
C4H10 |
C2H4 |
4∶1 |
|
② |
C4H10 |
C2H2 |
4∶1 |
|
③ |
C4H10 |
C3H6 |
3∶2 |
|
④ |
C4H10 |
C3H4 |
3∶2 |
(2)1L混合气可使含0.4mol溴的CCl4溶液完全褪色,说明混合气中不饱和烃与溴的物质的量比为1∶2,符合这一条件的只有②、③的两种组合。
|
A的分子式 |
C4H10 |
C4H10 |
|
B的分子式 |
C2H2 |
C3H6 |
15. 镁条在空气中燃烧生成氧化镁和氮化镁。将燃烧后的产物溶解在60毫升浓度为2.0mol/升的盐酸中,再用20毫升0.5mol/升NaOH溶液中和多余的盐酸,然后在此溶液中加过量的碱,把氨全部蒸出来,用稀HCl吸收,稀HCl增重0.17g,求镁带的质量。
分析:此题涉及反应较多,如按常规计算非常复杂,如巧用电荷守恒法可使计算大为简化。
该题反应变化的图式:
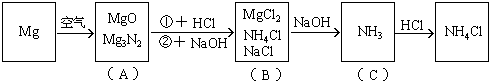
在图(B)中,根据电荷守恒,有下列关系:
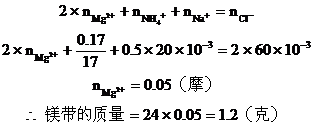
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com