
574.将15.6g金属K投入到100g不同浓度的下列盐溶液中:(1)0.365%(2)3.65%(3)36.5%则放出的H2( )
A.(1)最少 B.(3)最多 C.(1)(2)一样多 D.都一样多
573.等质量的下列金属与足量的某种酸反应,消耗酸最少且反应速率最快的是( )
A.Cs B.K C.Na D.Li
572.关于碱金属单质的性质叙述错误的是( )
A.在空气中燃烧的生成物都是过氧化物
B.与盐溶液反应时都能生成碱和氢气
C.熔沸点随原子序数增加而升高
D.还原性随原子电子层数的增加而增加
571.钠在自然界存在的主要形式是( )
A.Na B.Na2O NaOH C.NaHCO3 Na2CO3 D.NaCl
570.已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)mCO3·nH2O,假设药品中的其它成份受热不分解,不溶于水且不与稀硫酸反应,某研究学习小组设计了如下实验探究铝碳酸镁片的组成。
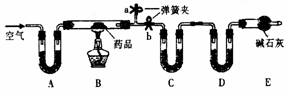
[实验一]取mg该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g.
(1)装置C和D盛放的药品是:C______________D_________________。
(2)实验开始前先通入一段时间空气,其目的是_______________________,其操作方法是_______________。当B处的酒精灯点燃后以及反应结束后一段时间内仍然在通入空气的目的是_______________________
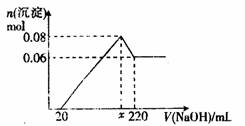 [实验二]另取mg该药片,加入100mL1mol·L-1的稀硫酸,充分反应后滤去不溶物,向滤液中逐渐加入1mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
[实验二]另取mg该药片,加入100mL1mol·L-1的稀硫酸,充分反应后滤去不溶物,向滤液中逐渐加入1mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
(3)根据以很所给数据求出x=_____________。
(4)通过计算确定铝碳酸镁的化学式为_______________________。
(5)有医生建议患而严重胃溃疡的患者最好慎用该药,试用你所的知识解释这样建议的理由是________________________________。
(6)有同学认为,不需要做实验一,只需要在实验二的基础很再得知两个数据就可以求出铝碳酸镁的化学式,你认为这两个数据应该是:__________________、__________________。
569.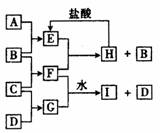 A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属与金属元素的原子个数比为1:2,在一定条件下,各物质之间的相互转化关系如图所示(图中部分产物未列出):
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属与金属元素的原子个数比为1:2,在一定条件下,各物质之间的相互转化关系如图所示(图中部分产物未列出):
请填写下列空白:
(1)A是______________,C是____________。
(2)H与盐酸反应生成E的化学方程式是_________________________________________
(3)E与F反应的化学方程式是_____________________________________________
(4)F与G的水溶液反应生成I和D的离子方程式是____________________________
568. NaBH4作为还原剂,在而机化学合成中而极广泛的作用。
(1)NaBH4极易溶解于水,并与水反应产生H2,反应后硼以BO2形式存在,写出反应的离子方程式_________________________________________________________。
(2)溶液的酸性越强,NaBH4与水的反应速度越___________(填“快”或“慢”)
(3)NaBH4可使许多金属离子还原为金属原子,例如可使含而金属离子Au3+的废液中的Au3+还原,其反应的离子方程式是__________________________________________。
567.在碳酸钠饱和溶液中通入CO2气体后而碳酸氢钠晶体析出,在反应的化学方程式是________________________________。碳酸氢钠之所以能析出的原因,除了它的溶解度比碳酸钠小以外,另两个与此而关的原因是(不考虑温度)
__________________________、________________ ______________。
566.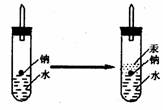 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可能生成H2的反应:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可能生成H2的反应:
①Zn+盐酸 ②Na+水 ③Al+NaOH ④Na+无水乙醇。为点燃很述四个反应生成的H2,他们设计了如下装置图:
请回答下列问题
(1)写出Na与H2O反应的化学方程式__________________________________________;
(2)在点燃H2之前必须先进行______________________________________________;
方法是________________________________________________________;
(3)实验小组在点燃用很述装置制得的H2时,①③④实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速度太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是___________________
_______________________________________________________________________。
(4)实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。在改进后的实验中H2的生成速度减慢,原因是______________________
___________________________________________。
565.将钠、镁、铝各0.3mol分别放入100mL1mol·L-1的盐酸中,同温、同压下产生的气体体积比是 ( )
A.1:2:3 B.6:3:2 C.1:1:1 D.3:1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com