
31.(8分)在常温常压下,把30mLNO2和O2的混合气体通入放置在水槽中充满水的量筒里,充分反应后,剩余5mL气体。求在原混合气体里NO2和O2各多少mL?
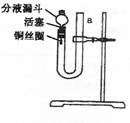
30.(14分)某课外学习小组,为探究稀HNO3能与
Cu反应生成无色的NO气体,设计了如图所示
的装置。请回答下列问题:
(1)请写出稀HNO3与Cu反应的离子方程式:
(2)写出向U形管中注入稀HNO3并将左管充满的操作过程:
。
(3)将左管充满稀HNO3的原因:
。
(4)实验开始时,反应很慢,为加快反应反应速率,应采取什么措施: 。
(5)实验中稀HNO3与Cu反应能否自动停止?为什么?
。
(6)在实验中,证明生成的无色气体是NO的操作是:
(7)为防止气体从分液漏斗上口外溢,污染空气,教师建议同学们在漏斗上口处堵一小团蘸有浓NaOH的棉花,将有毒气体吸收。其中一种气体与NaOH溶液反应生成亚硝酸盐和硝酸盐,请写出化学方程式:
29.(12分)化合物A的周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的氢氧化物可与盐酸反应,又可与NaOH溶液反应,X原子的电子式为
。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①X与H2O2反应,其产物之一是Y的单质,Y单质的电子式是 ,
Z分子的结构呈 。
②A的化学式是 。
(4)X的单质、石墨的二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应化学方程式是
 四、实验题
四、实验题
28.(14分)
(1)将等物质的量的C12和SO2气体通入滴和石蕊试液的BaC12溶液中,出现的现象是
。
用方程式简述产生此现象的原因
。
(2)在CO2中混有少量的SO2、SO3、HC1杂质。请用①饱和NaHCO3 ②饱和NaHSO3 ③浓硫酸(可吸收SO3,可重复使用)三种试剂,设计一种一步只除去一种杂质,最后得到干燥纯净CO2的实验方案,填写下表。(试剂用编号表示)
|
依次选用的试剂 |
|
|
|
|
|
除去的杂质 |
|
|
|
|
27.(12分)A、B、C、D、E为原子序数依次递增的短周期元素:已知E的原子核内质子数正好等于B的原子核内质子数的2倍,且最外层电子数相等;D的最外层电子数等于其电子层数;A的最外层电子数为次外层电子数的2倍;C、D同周期,且C的最高价氧化物对应水化物与D的氧化物在常温下发生反应生成盐和水,请根据上述情况完成以下问题:
(1)C的元素符号 E的原子结构示意图
(2)写出A与B形成的稳定化合物的电子式 ,B与C形成稳定化合物中含有化学键的类型有 。
(3)B、C、D、E形成的离子半径由大到小的顺序(用具体的离子符号表示)
(4)写出C的最高价氧化物对应水化物与D的氧化物反应的离子方程式
。
26.(6分)某混合气体中可能含有N2、O2、C12、HC1、NH3、NO、NO2中的两种或多种气体,现将此无色透明的混合气体通过浓硫酸后,气体体积明显减小,当剩余气体与空气接触时,立即变为红棕色,则原混合气体中一定含有的气体是 ,一定不存在的气体是 ,可能存在的气体是 。
25.下列试剂的贮存方法中正确的是 ( )
①浓硝酸存放在棕色试剂瓶中 ②少量白磷存放在水中
③液溴保存在水中 ④少量金属钠贮存在煤油中
⑤氢氟酸保存在玻璃瓶中 ⑥烧碱溶液盛放在带玻璃塞的玻璃瓶中
A.全对 B.只有①②③ C.只有①②③④ D.只有⑤⑥
第Ⅱ卷(非选择题,共75分)
24.7g铜、银合金与足量的某浓度的硝酸反应,把放出的气体与560mL(标准状况)氧气混合,通入水中气体全部被吸收。则合金中银的质量为(不考虑2NO2
N2O4)( )
A.1.6g B.5.4g C.2.16g D.无法确定
23.A气体(氯气与二氧化氮混合)和B气体(二氧化硫和氧气混合)的平均相对分子质量分别为51和48将A,B混合后通入盛满水的倒立在水槽中的试管中,反应后试管中无气体存在,则A,B两气体的体积比是 ( )
A.5:2 B.1:2 C.1:1 D.4:1
A.b元素除零价外,只有一种化合价
B.五种元素中,a元素的性质最稳定
C.c的氧化物晶体中,c原子和它拥有的化学
键个数比为1:2
D.e元素最高价氧化物的水化物的酸性比d元
素最高价氧化物的水化物的酸性弱
22.标况下,在四个干燥的烧瓶内分别装入:干燥纯净的HC1气体、含一半空气的氨气、NO2气体、NO2和O2的混合气体[V(NO2):V(O2)=4:1]。然后分别作喷泉实验,四个烧瓶中所得溶液的物质的量浓度之比为 ( )
A.2:1:2:2 B.5:5:5:4 C.1:1:1:1 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com