金属材料在生活、生产中应用十分广泛.
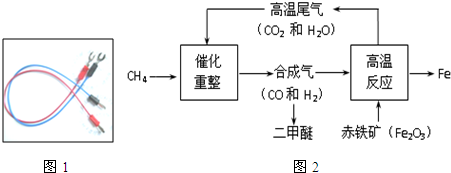
(1)如图1是金属铜的一个应用实例,利用了金属铜的
导电
导电
性.
(2)铝制品在空气中不易锈蚀,原因是铝有“自我保护”作用,产生致密的保护膜,铝在空气中“自我保护”反应的化学方程式为
4Al+3O2═2Al2O3
4Al+3O2═2Al2O3
.
(3)若只用一种金属单质,两种盐溶液,来验证锌、铜、银三种金属活动性顺序,则验证过程中所涉及的化学方程式为
Cu+2AgNO3═Cu(NO3)2+2Ag
Cu+2AgNO3═Cu(NO3)2+2Ag
.用铝丝与硫酸铜溶液反应完成“铜树”实验时,先要除去铝丝表面的氧化膜,常用的物理方法是
用砂纸打磨
用砂纸打磨
,若用稀盐酸处理,当看到
有气泡产生
有气泡产生
现象时,表明氧化膜已被破坏.
(4)合成气(CO和H
2)可用于制备被称为21世纪新型燃料的二甲醚(CH
3OCH
3),还可用于冶炼金属,其部分生产过程示意图如图2所示;
①二甲醚(CH
3OCH
3)可由合成气(CO和H
2)在一定的条件下制得.反应过程中CO和H
2按分子个数比1:2进行反应,制得二甲醚时,生成的另一种物质是
H2O
H2O
.
②根据示意图中标示的物质,合成气在冶炼铁的生产过程中发生了两个重要的反应,其中不属于置换反应的化学方程式为
.




 阅读快车系列答案
阅读快车系列答案
 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.
 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛. 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.