解:(1)根据题意,生成物是CO和H
2,条件是高温,根据方程式书写要求可以写出.CH
4+H
2O

CO+3H
2(2)I.根据化学方程式知CO和H2的质量比=28:(2×3)=14:3
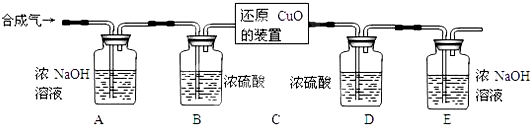
Ⅱ.[完善实验设计]分析所用各装置中的反应条件可知,装置C中氢气和氧化铜反应需要加热,对应实验步骤为②.
[进行实验]
①反应后装置C中黑色的氧化铜逐渐变为红色的铜,所以装置C中的固体是铜,为红色.
[现象分析和数据处理]
②如果只有CO和H
2,还原足量CuO,合成气中CO与H
2的分子个数比为1:3.生成物中碳元素与氢元素的质量比为2:1;如果只有CH
4还原足量CuO,生成物中碳元素与氢元索的质量比为3:1.现测得CO
2的质量:201.5g-198.2g=3.3g,H
20的质量:296.0g一292.4g=3.6g
生成物中碳元素与氢元素的质量比:(3?3g×
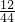
):(3.6g×
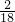
)=9:4,9;4介于2:1和3:1之间,由此可推测出,除了CO和H
2以外,制得的合成气中可能还有来反应的CH
4,且CH
4也还原了CuO
③否.因为带走水蒸气会使测得的CO
2质量偏低,而实际测得的生成物中碳、氢元素的质量比已经大于2:1,所以对推测结果无影响.
[拓展探究]要证明甲烷还原氧化铜,只要证明生成物中有CO
2和H
2O生成即可,所以F装置应是检验CO
2生成的,用澄清石灰水.装置H是还原CuO,G是用来证明水的生成,F是证明二氧化碳生成,I是处理尾气,所以顺序为HGFI.
[实验反思]因为本题是定量性实验,反应物是混合物,在以上的讨论中对反应物参加的可能性进行了分析证明,影响生成物的质量变化的还有参加反应的物质质量大小以及反应过程中是否全部参与反应.所以可以从这两方面进行分析证明.
故答案为:
(1)CH
4+H
2O

CO+3H
2(2)I.14:3
Ⅱ.[完善实验设计]②
[进行实验]红
[现象分析和数据处理]
②如果只有CO和H.还原足量CuO,合成气中CO与H
2的分子个数比为1:3.生成物中碳元素与氢元素的质量比为2;1
如果只有CH
4还原足量CuO,生成物中碳元素与氢元索的质量比为3:1
现测得CO
2的质量:201.5g-198.2g=3.3g H
20的质量:296.0g一292.4g=3.6g
生成物中碳元索与氢元索的质量比:(3?3g×
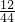
):(3.6g×
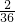
)=9:4
9;4介于2:1和3:1之间
由此可推测出,除了CO和H
2以外,制得的合成气中可能还有来反应的CH
4,且CH
4也还原了CuO.
③否.因为带走水蒸气,将会导致E装置的质量增加减小,从而会使测得的CO
2质量偏低,(二氧化碳的质量就是两次称量E装置的质量差),而实际测得的生成物中碳、氢元素的质量比已经大于2:1,所以对推测结果无影响.
[拓展探究]澄清石灰水 H G F I
[实验反思]因为根据测得数据计算,生成物中碳、氧元素的质量比值2:1,所以可能是合成气中参与反应的CO与H
2分子个数比大于1:3(或H
2未完全参加反应、生成的水未被完全吸收等).
分析:(1)根据题中信息结合方程式书写要点书写.
(2)I.根据化学方程式的意义来分析求解.
Ⅱ.[完善实验设计]可分析各装置中发生反应的条件即可.
[进行实验]①可根据反应中各物质的物性来分析.
[现象分析和数据处理]
②分析表中数据可知生成物中CO
2、H
2O的质量,采用极端分析法讨论若全部是CO和H
2参与反应得到的CO
2、H
2O的质量比与全部是甲烷参与反应得到的二者相比较来分析.
③若带着E装置中的部分水蒸气,对实验数据来说就是测得的H
2O的质量将减小.即CO
2和H
2O的质量比增大,可以和实际试验数据相比较进行分析.
[拓展探究]
①要证明CH
4参与反应,就是要证明反应后生成了CO2和H
2O.
②根据反应过程来确定顺序,一般验证气体先验证水蒸气,因为中间反应可能带入水汽.
[实验反思因为合成气中有CH
4、CO、H
2O,是混合气参与的反应,参加反应的物质质量比并不是定值.
点评:本题是一道综合性实验探究题,对培养学生分析问题解决问题的能力有一定的提高.



 CO+3H2
CO+3H2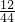 ):(3.6g×
):(3.6g×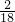 )=9:4,9;4介于2:1和3:1之间,由此可推测出,除了CO和H2以外,制得的合成气中可能还有来反应的CH4,且CH4也还原了CuO
)=9:4,9;4介于2:1和3:1之间,由此可推测出,除了CO和H2以外,制得的合成气中可能还有来反应的CH4,且CH4也还原了CuO CO+3H2
CO+3H2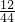 ):(3.6g×
):(3.6g×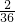 )=9:4
)=9:4

 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有:
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有: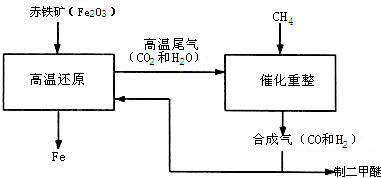
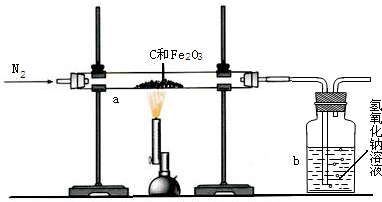
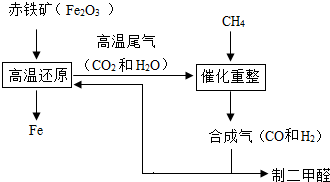
 (2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程.
(2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程. (1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为
(1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为