
| A.H2 | B.S | C.Mg | D.P |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
(2010?闵行区二模)将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
|
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Fe丝消失的时间/S |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3[来源:] |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |

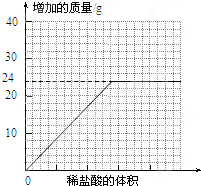
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.请用以下方法解决下列问题:
(1)分类法:利用下列4组物质请按要求填写下表空白(填写物质的化学式或分类标准)
(分类标准包括:酸、碱、盐、金属氧化物、非金属氧化物、金属单质、非金属单质)
A.ZnO、MgO、CO2、Na2O B.Cu、N2、C、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
| A | B | C | D | |
| 分类标准 | 金属氧化物 | 盐 | ||
| 不属于该类别的物质 | Cu | H2O |
(2)对比法:
A.通过对CO2+H2O→H2CO3 和 6CO2+6H2O 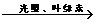 C6H12O6+6O2两个化学反应的
C6H12O6+6O2两个化学反应的
 对比,你能得出的结论是:相同的反应物在不同的条件下
对比,你能得出的结论是:相同的反应物在不同的条件下
.
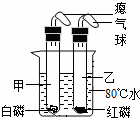
B.如图所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙
试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过
一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请
根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之
一: 。
(3)归纳演绎法:
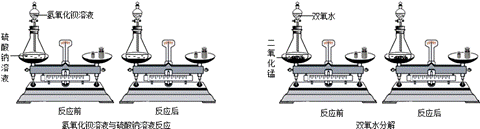
某同学通过对大量化学反应前后各物质的质量总和的测定分析(如上图中的氢氧化钡溶
液与硫酸钠溶液,用少量的双氧水和二氧化锰分解),得出参加化学反应的各物质的质量总和 (填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.根据该同学得出的结论可推出:高温煅烧含有杂质的石灰石125g(杂质不发生反应),
充分反应后剩余固体质量为81g,则反应过程中生成二氧化碳的质量为 g。
请根据化学反应方程式列式计算①该石灰石中含碳酸钙的物质的量是多少?②该石灰石
中含碳酸钙的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源:2010年上海市闵行区中考化学二模试卷(解析版) 题型:选择题
| 物 质 | a | b | c | d |
| 反应前质量/g | 64 | 32 | 40 | 1.0 |
| 反应后质量/g | 待测 | 25.6 | 72 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com