
分析 物质的性质决定物质的用途,
(1)根据加热煮沸降低水的硬度;活性炭具有吸附性,能吸附异味和色素;
(2)煤做成蜂窝状增大了煤与氧气的接触面积;
(3)根据硬水软水的检测方法分析;
(4)用盐酸除水垢是由于盐酸能将不溶性的碳酸钙和氢氧化镁通过化学反应转化成可溶性物质.
解答 解:(1)加热煮沸降低水的硬度;活性炭具有吸附性,能吸附异味和色素,生活用水在净化过程中常用活性炭吸附色素和异味.
(2)将煤做成蜂窝状,能增大与氧气的接触面积,使煤与氧气充分接触而发生完全燃烧;
(3)可用肥皂水鉴别硬水和软水,其中产生泡沫较多的是软水,泡沫较少的是硬水;
(4)盐酸与水垢中的氢氧化镁反应生成氯化镁和水,该反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O.
故答案是:(1)煮沸; 活性炭;
(2)增大煤与空气或氧气的接触面;
(3)肥皂水;
(4)Mg(OH)2+2HCl═MgCl2+2H2O.
点评 本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2g氢气与18g氧气反应,根据质量守恒推出生成的水的质量为20g | |
| B. | 丙烷燃烧生成二氧化碳和水,根据元素守恒推出丙烷由碳、氢、氧元素组成 | |
| C. | 100mL36%的浓盐酸用300 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为9% | |
| D. | 相同分子数的CO和O2混合,在一定条件下充分反应,根据原子守恒推出反应后气体中C、O原子数比为1:3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
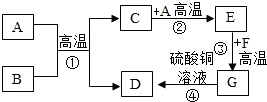 A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题:
A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 为降低成本,用工业明胶制药胶囊 | |
| B. | 在乳制品中添加“皮革蛋白粉”,以提高蛋白质含量 | |
| C. | 目前我国多省份大力推广“加铁酱油”,以预防缺铁性贫血 | |
| D. | 将地沟油和泔水油回收用来炒菜,以达到变废为宝、节约资源的目的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
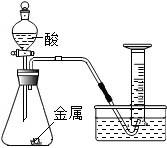 某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:| 实验编号 | 选用金属 (均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 0~1min | 1~2min | 2~3min | 3~4min | 4~5min | 前5min共收集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 47.6 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Al2O3 | B. | Fe | C. | Fe2O3 | D. | Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com