
 图A是某粒子的结构示意图,B是铝元素在元素周期表中的信息.
图A是某粒子的结构示意图,B是铝元素在元素周期表中的信息.分析 本题考查学生对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.根据已有的知识进行分析解答,在原子中,核内质子数=核外电子数,在阳离子中,核内质子数>核外电子数,在阴离子中,核内质子数<核外电子数,据此解答.
解答 解:(1)当m<(10+n)时,该阴粒子是由原子得到电子形成的,当最外层电子数大于4时易得到电子,所以原子的最外层电子数可能是:5、6、7.该阴粒子的符号可能为:N3-、S2-、Cl-;
(2)当m=16时,A元素原子的最外层电子数是6,大于4,在反应中易得到两个电子,在化合物中形成的化合价可能为-2价;
(3)当m=17时,A元素是氯元素,与金属形成化合物时显-1价,B是铝元素,化合价是+3价,化合物的化学式为AlCl3.
故答案为:(1)N3-、S2-、Cl-;(2)-2;(3)AlCl3.
点评 本题考查学生对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:初中化学 来源: 题型:解答题
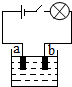 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:| 物质 导电性 状态 | 食盐 NaCL | 硝酸钾 KNO3 | 蔗糖 C12H22O11 | 氢氧化钠 NaOH | 硫酸铜 CuSO4 |
| 固态 | × | × | × | × | × |
| 溶化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | n | B. | 2n | C. | 3n | D. | 4n |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 选用药品 | 发生装置(填序号) | 收集装置(填序号) | 反应原理(化学方程式) |
| 过氧化氢溶液 二氧化锰 | ① | ③ | ④ |
| 高锰酸钾 | ② | ⑤ |
| 药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg块状 | Mg块状 | Mg粉末状 | Mg粉末状 |
| 盐酸(过量) | Wg稀盐酸 | Wg浓盐酸 | Wg稀盐酸 | Wg浓盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com