
 用来测定空气成分的方法很多,如图所示的是用红磷在空气中燃烧的测定方法.待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,并且进入集气瓶中水的体积约为集气瓶总容积的五分之一.
用来测定空气成分的方法很多,如图所示的是用红磷在空气中燃烧的测定方法.待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,并且进入集气瓶中水的体积约为集气瓶总容积的五分之一. ,你认为导致这一结果的原因可能是________、________、________.
,你认为导致这一结果的原因可能是________、________、________.
 ,导致这一结果的原因可能是,红磷过少、点燃红磷后,未迅速插入橡胶塞、装置漏气、未冷却到室温就打开止水夹、红磷中含有燃烧时产生不溶于水气体的杂质等.故答案为:红磷过少、点燃红磷后,未迅速插入橡胶塞、装置漏气、未冷却到室温就打开止水夹、红磷中含有燃烧时产生不溶于水气体的杂质等.(任写三点)
,导致这一结果的原因可能是,红磷过少、点燃红磷后,未迅速插入橡胶塞、装置漏气、未冷却到室温就打开止水夹、红磷中含有燃烧时产生不溶于水气体的杂质等.故答案为:红磷过少、点燃红磷后,未迅速插入橡胶塞、装置漏气、未冷却到室温就打开止水夹、红磷中含有燃烧时产生不溶于水气体的杂质等.(任写三点)

科目:初中化学 来源: 题型:阅读理解
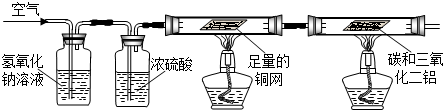
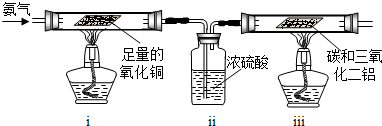
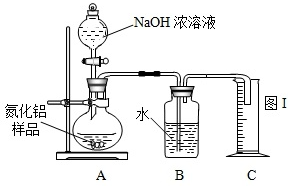
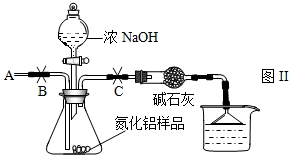
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| 猜 想 | 简 要 实 验 方 案 | 现 象 | 结 论 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
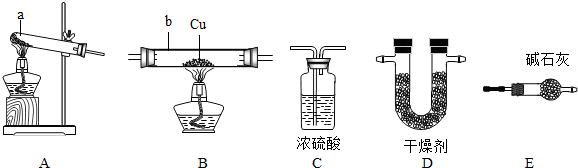
 NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO
NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO 3Cu+N2+3H2O;④氨气密度小于空气,极易溶于水,具有强烈的刺激性气味,是空气的污染物之一.
3Cu+N2+3H2O;④氨气密度小于空气,极易溶于水,具有强烈的刺激性气味,是空气的污染物之一.
| 猜 想 | 简 要 实 验 方 案 | 现 象 | 结 论 |
查看答案和解析>>
科目:初中化学 来源:2011年江苏省镇江市丹阳九中中考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com