
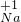 ,
,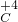 ,
,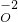 ,
,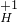 ,
,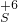 ,
,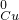 中的元素填写符合下列题意的化学式各一个:单质______,碱______,盐______.
中的元素填写符合下列题意的化学式各一个:单质______,碱______,盐______.解:
(1)由题意知,六种元素的化合价为: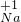 ,
,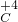 ,
,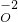 ,
,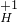 ,
,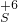 ,
,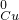 中,可知硫酸根为-2价,氢氧根为-1价:
中,可知硫酸根为-2价,氢氧根为-1价:
单质:化合价为0,故为铜,其化学式直接用元素符号表示,故为Cu.
碱:为氢氧化钠,因化学式的书写“正左负右”,标注化合价 ,利用化合价数值交叉法,故化学式为NaOH;
,利用化合价数值交叉法,故化学式为NaOH;
盐:为硫酸钠,因为化学式的书写“正左负右”,标注化合价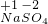 ,用化合价数值交叉法,故化学式为Na2SO4;
,用化合价数值交叉法,故化学式为Na2SO4;
(2)2个氧原子的符号:2O;3个钠离子的符号:3Na+.
故答案为:
(1)Cu;NaOH;Na2SO4(合理即可);
(2)2O;3Na+
分析:
(1)首先要熟记常见元素与常见原子团的化合价以及化合价的规律和原则(根据化合价的原则:在化合物中正、负化合价的代数和为零),弄清化合价数值交叉法书写化学式(即将正、负化合价的数值交叉到相应符号的右下角,但注意原子团看作一体,含约数的一般要约分)的方法.
(2)元素符号能表示该元素的一个原子,知道钠元素的化合价即可知道钠离子带几个单位的正电荷数.
点评:本题考查了学生对化学式的书写方法和技巧;考查了常见元素与常见原子团的化合价以及化合价的规律和原则.


科目:初中化学 来源: 题型:
 所表示的粒子名称是
所表示的粒子名称是查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| “花瓣指示剂” 序号 |
花的名称 | “花瓣指示剂颜色 | 在不同物质中呈现的颜色 | ||
| 白醋 | 蒸馏水 | 石灰水 | |||
| ① | 牵牛花 | 紫 | 红 | 紫 | 蓝 |
| ② | 月季 | 红 | 红 | 红 | 蓝 |
| ③ | 万寿菊 | 黄 | 黄 | 黄 | 黄 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)如图1,用红磷燃烧来测定空气中氧气的含量,实验过程中发生的实验现象是:
(1)如图1,用红磷燃烧来测定空气中氧气的含量,实验过程中发生的实验现象是:| 点燃 |
| 点燃 |
| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验次数 | 1 | 2 | 3 | 4 |
| H2O2溶液的溶质质量分数 | 1% | 5% | 10% | 15% |
| MnO2质量 | 0.2克 | 0.2克 | 0.2克 | 0.2克 |
| 气泡产生的速率 | + | ++ | +++ | ++++ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com