
下列常见仪器的使用正确的是_______
A.量筒用作反应容器 B.烧杯放在石棉网上加热
C.用温度计搅拌溶液 D.熄灭酒精灯,应该_______
科目:初中化学 来源:吉林省2018届九年级上学期第一次月考化学试卷 题型:选择填充题
对生活中下列现象的解释错误的是:
现 象 | 解 释 | |
A | 湿衣服在夏天比在冬天干得快 | 温度升高,分子运动速率加快 |
B | 6000L氧气在加压下可装入容积为40L的钢瓶中 | 气体分子间间隔大,易于压缩 |
C | 在无外力下,花粉会在平静的水面上移动 | 分子在不断运动 |
D | 自行车轮胎在阳光下暴晒而炸裂 | 分子受热,体积变大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源:安徽省2018届九年级上第一次月考化学试卷 题型:信息分析题
空气中按体积分数计算,氮气___________,氧气_______,稀有气体_________,二氧化碳_______。
查看答案和解析>>
科目:初中化学 来源:江西省2018届九年级上学期第一次月考化学试卷 题型:简答题
实验室用高锰酸钾来制取氧气。经探究,生成氧气的质量约是高锰酸钾质量的十分之一。
(1)现有高锰酸钾32g,大约能生成氧气的质量为 g(保留一位小数)。
(2)这些氧气若装在容积为500ml的集气瓶中,最多装满几瓶?(氧气在该条件下的密度为1.429g/L)(写出简单计算过程)
(3)正常人每分钟约呼吸20次,每次约吸入0.4L空气。请问一人一小时吸入体内的氧气约为多少升?(写出简单计算过程)
查看答案和解析>>
科目:初中化学 来源:江西省2018届九年级上学期第一次月考化学试卷 题型:信息分析题
简要说明下列操作可能造成的不良后果:
(1)向燃着的酒精灯里添加酒精___________________;
(2)倾倒细口瓶里的药液时,标签没有向着手心________________;
(3)被加热的试管外壁有水_________________;
(4)实验剩余的药品放回原瓶_____________________;
(5)加热液体时,试管口朝着有人的地方______________________;
(6)用冷水洗涤刚加热过的试管________________________。
查看答案和解析>>
科目:初中化学 来源:江西省2018届九年级上学期第一次月考化学试卷 题型:选择填充题
实验室加热约50ml液体,可以使用的仪器是
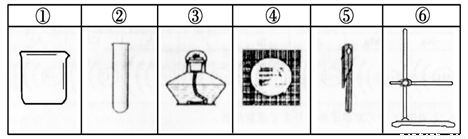
A. ①③④⑤ B. ①③④⑥ C. ②③④⑥ D. ②③⑤⑥
查看答案和解析>>
科目:初中化学 来源:江苏省扬州市树人学校2017届九年级中考三模化学试卷 题型:探究题
铜及其化合物在生产、生活中都有广泛的应用。
一、铜的性质及其应用
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。
(1)青铜器属于______(填序号)。
A.无机材料 B.合成材料 C.复合材料 D.复合肥
(2)铜绿分解的化学方程式为_____________________。
(3)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“ ”为铜片)。
”为铜片)。
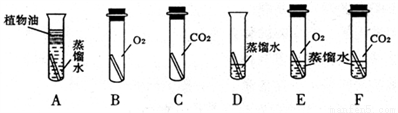
实验较长时间后,发现_____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和______(写出试管中需要的物质)。可以省略不做的实验是试管______(填试管编号)。
二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
方法二:湿法炼铜:CuSO4+Fe=FeSO4+Cu
(4)上述两种方法中,你认为哪种方法更好________,原因是__________(写出1条原因即可)。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S 80%的辉铜矿_____t(取整数)。
三、铜的化合物的制备研究
碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:

(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用______(填序号)。
a.Fe2O3 b. CaCO3 c.CuO
(6)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5____ 。
(7)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_________。
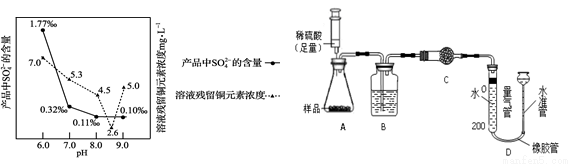
(8)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如右上图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
实验步骤如下:①连接装置并_______;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10ml;④向锥形瓶内加入50ml(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml。
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是 ____,少量植物油的作用是______,C中的试剂是 _____(填字母序号);
a.碱石灰 b.浓硫酸 c.无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管 _____(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程)_________。(保留到0.1%)
Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是______(填字母序号);
A.步骤③中平视刻度,步骤⑥中仰视读数
B.硫酸的用量不足
C.量气管中未加植物油
D.步骤⑥中没有调节量气装置两边液面相平,直接读数
(9)碱式碳酸铜【xCuCO3·yCu(OH)2·zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如下图。
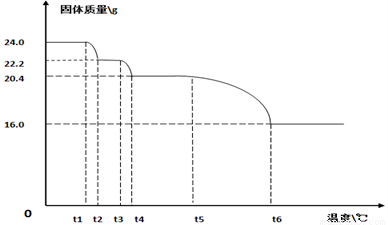
(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)
Ⅰ.通过计算可得x:y:z=_________ ;
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:_____________。
查看答案和解析>>
科目:初中化学 来源:江苏省扬州市树人学校2017届九年级中考三模化学试卷 题型:选择填充题
下列有关水的知识,其中正确的是
A. 自然界中的水中大多数为纯净物
B. 农业上合理使用化肥和农药有利于水资源的保护
C. 只有用蒸馏的方法才能降低水的硬度
D. 我国可利用的淡水资源十分丰富
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com