
【题目】a、b、c三种固体物质的溶解度曲线如图所示:

(1)P点表示___________________________________ 。
(2)将接近饱和的c溶液变为饱和溶液,可采用____________的方法(写出一种)。
(3)t2℃时,将30g的a物质加入到50g水中充分搅拌,所得溶液质量为___________g。
科目:初中化学 来源: 题型:
【题目】某化学学习小组的同学在学习了《常见的酸》以后,对蚊虫分泌的让人痛痒不止的蚁酸产生了兴趣。他们在老师指导下对蚁酸进行探究。
(查阅资料)蚁酸的主要成分是甲酸,甲酸的化学式为HCOOH;甲酸溶于水,在一定条件下发生分解反应生成两种氧化物。
(提出问题)甲酸溶液是否具有酸性?
(实验与结论)向盛有甲酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明甲酸溶液显____性。
(提出问题)甲酸分解生成的两种氧化物是什么?
(推断与猜想)
⑴小组同学根据甲酸中含有氢元素,推测出生成物中含有水。
⑵他们对另一种氧化物提出两种猜想:猜想①:二氧化碳;猜想②:一氧化碳。
(实验与结论)
为了证明自己的猜想,他们将甲酸分解产生的气体通过如下图所示的装置(铁架台已略去)。
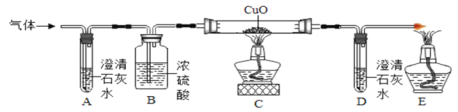
观察到的实验现象如下:
Ⅰ.装置A中澄清石灰水无明显变化。
Ⅱ.装置C中的黑色粉末变红色。
Ⅲ. 装置D中澄清石灰水变浑浊。
(实验结论)甲酸具有酸性,在一定条件下分解生成水和_______。
(拓展延伸)人被蚊虫叮咬后,在其叮咬处涂抹______________可减轻痛痒。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为某化学反应的微观过程,其中“![]() ”和“
”和“![]() ”表示两种不同原子.
”表示两种不同原子.
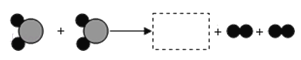
(1)虚线框内应填的微观图示是______(选填A、B、C、D),你推断的依据是___________。
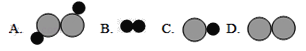
(2)写出符合该微观示意图的一个具体反应的化学方程式:_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钠、钾在元素周期表中的信息如图所示,下列判断不正确的是( )
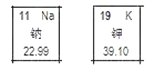
A. 钠原子和钾原子最外层电子数都是 1,所以位于同一族
B. 钠、钾都是金属元素
C. 等质量的金属钠、钾中含有原子个数最多的是钾
D. 钠元素位于元素周期表中的第三周期
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验室中采用如右图所示的装置能得到干燥的氧气B 中盛放的试剂是____________,如何检验 C 中氧气已经集满_________?不需改动装置,只需更换 A 中的药品就可制得另一种干燥的气体,写出此时 A 中反应的化学方程式.____________
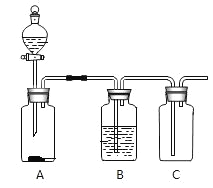
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,图为该反应的微观示意图。下列说法正确的是( )
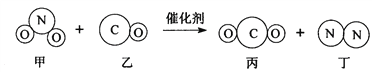
A. 生成的丙和丁的分子个数比为1∶1
B. 反应前后,碳和氮的化合价发生了改变
C. 反应前后,元素的种类没有改变,原子的个数发生了变化
D. 乙和丙的元素组成相同,所以它们的化学性质相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰(主要成分为CaO)制备高纯氧化钙的工艺流程如下:
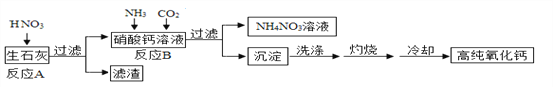
请回答下列问题:
(1)过滤操作中玻璃棒的作用是_______________;
(2)反应B的化学方程式为________________________;
(3)灼烧时发生反应的化学方程式为_________,该工艺流程中可循环使用的物质是_________;
(4)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙中会混有的两种杂质名称分别是___________和__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学探究和证据推理是化学学科的核心素养。学习小组对蓝绿色碱式碳酸铜晶体[Cu2(OH)2CO3]的性质进行实验探究,并基于证据进行推理分析。
I.分析碱式碳酸铜的组成
根据化学式可知,碱式碳酸铜中Cu元素的化合价为_____。
Ⅱ.探究碱式碳酸铜受热的变化
(设计实验)学习小组设计了如图装置(夹持仪器已略去),并用于探究碱式碳酸铜的分解产物。
(实验过程)
①在装置丙导管a处连接一导管,并插入水中,微热试管,观察到_____,说明整套装置的气密性良好。
②按图示加入样品和试剂,加热一段时间后,试管中固体变黑,U形管中无水硫酸铜变蓝,澄清石灰水变浑浊。
(实验分析)
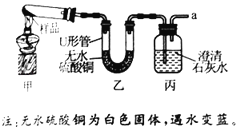
①装置甲中用于加热的仪器名称为_____。
②装置丙中发生反应的化学方程式为_____。
③根据现象可知,碱式碳酸铜受热可分解,分解产物有CO2、CuO、_____。
④装置乙、丙位置不能互换的理由是_____。
Ⅲ.探究碱式碳酸铜与酸的作用
(实验过程)取样品少量于试管中,加水,固体不溶解。继续加入足量稀硫酸,有气泡产生,得到蓝色溶液。
(实验结论)碱式碳酸铜能与硫酸发生反应,生成的盐为_____。
(拓展延伸)碱式盐在生活中应用广泛。碱式氯化铝[Al2(OH)Cl5]是一种高效净水剂。写出碱式氯化铝与盐酸发生反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有Cu2(OH)2CO3[Mr=222]与Cu的混合物25.4g,在空气中加热一段时间,得剩余固体23.1g,向该固体中加入300.0g9.8%的稀硫酸,固体完全溶解,测得反应过程中实际消耗9.8%的稀硫酸250.0g。下列说法正确的是
A. 剩余固体为纯净物
B. 上述加热过程中共生成H2O和CO2的质量为2.3g
C. 原混合物中Cu2(OH)2CO3与Cu的质量比为111:16
D. 最终所得溶液质量为318.7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com