
【题目】实验是进行科学探究的重要手段。请回答下列问题
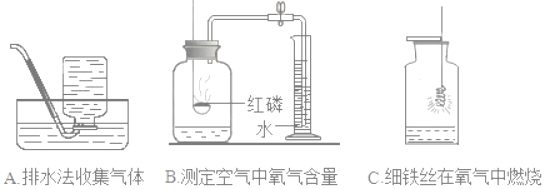
(1)实验A集气瓶内装满水的目的是_____;
(2)实验B通过_____现象,可得出氧气约占空气体积五分之一的结论
(3)实验C中水的作用是_____;实验时,若观察不到燃烧的现象,原因可能是_____。
【答案】排尽瓶内空气,收集气体更纯 量筒内的水进入集气瓶大约集气瓶的容积的![]() 防止高温熔融物炸裂集气瓶底 氧气浓度低(或没有除锈或温度未达到铁丝的着火点)
防止高温熔融物炸裂集气瓶底 氧气浓度低(或没有除锈或温度未达到铁丝的着火点)
【解析】
(1)实验A是利用排水法收集气体,集气瓶内装满水的目的是排尽集气瓶内的空气,使收集的气体更纯;
(2)实验B是测定空气中氧气的体积含量,红磷燃烧消耗氧气,集气瓶内气体减少,压强变小,冷却至室温,量筒内的水进入集气瓶中,通过进入的水大约占集气瓶内水面以上容积的![]() 的现象,可得出氧气约占空气体积
的现象,可得出氧气约占空气体积![]() 的结论。
的结论。
(3)铁丝燃烧放出大量的热,会使固体熔化为液体落到集气瓶中而炸裂瓶底,实验C中水的作用是防止高温熔融物炸裂集气瓶底;实验时,若观察不到燃烧的现象,原因可能是氧气浓度低、没有除锈或未温度未达到铁丝的着火点等。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】下列图像能正确反映对应的实验操作的是( )
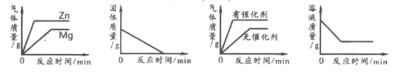
A. 把等质量的镁和锌加入足量的稀盐酸中B. 加热一定量高锰酸钾固体产生氧气
C. 用一定量的双氧水制取氧气D. 向一定量的硝酸银溶液中插入铜丝
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收,丙氨酸(化学式为C3H7O2N)就是其中的一种.请回答下列问题:(提示:H﹣1 C﹣12 N﹣14 O﹣16)
(1)丙氨酸分子中C、H、O、N各原子的个数比为_____;
(2)丙氨酸的相对分子质量是_____.
(3)丙氨酸中碳、氢、氧三种元素的质量比_____.
(4)丙氨酸中氮元素的质量分数是多少?____(计算结果精确到0.1%)
(5)17.8g丙氨酸中含有氧元素多少g?____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、c三种固体物质的溶解度曲线,下列说法中正确的是(_____)
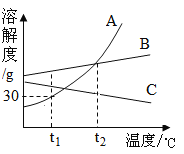
A.![]() ℃时,65gA的饱和溶液中含有50g溶剂
℃时,65gA的饱和溶液中含有50g溶剂
B.在![]() ℃,A、B两种物质的溶液溶质质量分数相同
℃,A、B两种物质的溶液溶质质量分数相同
C.将![]() ℃A、B、C三种物质的饱和溶液升温至
℃A、B、C三种物质的饱和溶液升温至![]() ℃时,溶液中溶质质量分数由小到大的顺序为C<B=A
℃时,溶液中溶质质量分数由小到大的顺序为C<B=A
D.当A中含有少量B时,提纯A的方法是____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在20℃时,某固体物质(不含结晶水)的水溶液,经历如图变化,下列说法正确( )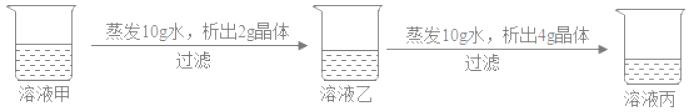
A. 溶液甲是饱和溶液
B. 20℃时,溶液丙若蒸发10g水,析出晶体一定大于4g
C. 溶液乙是饱和溶液
D. 溶液质量分数:乙<丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】目前,中国某汽车厂家正在积极探究、开发生产新能源汽车,并宣布在2025年停止传统燃油汽车的生产。下图是一款新能源电动汽车的示意图:
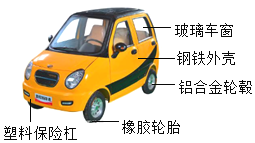
(1)图中标识的材料中,含有的金属元素是____(写出一种即可)。
(2)汽车外壳一般采用喷漆的方式防锈,其原理是_______。
(3)汽车轮毂为铝合金材质,具有很好的抗腐蚀性,其原因是_____________(用化学方程式表示)。
(4)传统燃油汽车由于汽油燃烧不充分会产生_________,同时排放出氮的氧化物和烟尘等污染物;请写出另一种可以为汽车提供动力的新能源:______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
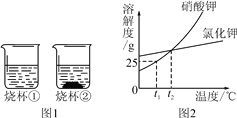
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关图象中不正确的是
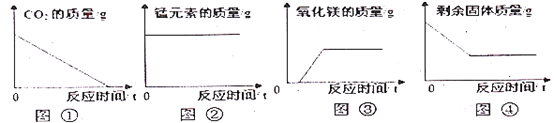
A. 图①是一定量的碳在过量的氧气中燃烧
B. 图②是加热高锰酸钾制取氧气
C. 图③是镁条在密闭容器中燃烧
D. 图④是活性炭与氧化铜粉末在高温下恰好完全反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质),某课题组以此粉末为原料进行资源回收,其工艺流程如下:
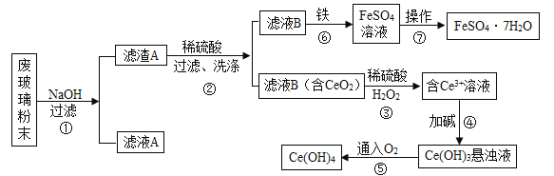
(1)写出第②步反应的化学方程式__________。
(2)洗涤滤渣B的目的是为了除去_____(填离子符号)。
(3)第③步反应中Ce元素由_______价变成+3价。
(4)第⑦步操作是把FeSO4溶液经蒸发浓缩、________、过滤、洗涤、干燥等步骤得到绿矾FeSO4·7H2O。
(5)若第④步加的碱为NaOH溶液,写出生成Ce(OH)3的反应方程式_________。
(6)请补充完整第⑤步反应的化学方程式:4Ce(OH)3+O2+_____=4Ce(OH)4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com