
【题目】Na2CO3和NaHCO3有相似的化学性质,都能与酸、某些碱反应。但碳酸钠稳定,而 NaHCO3受热分解:2NaHCO3![]() X+H2O+CO2↑。
X+H2O+CO2↑。
(1)生成物X的化学式为______。
(2)工业上用碳酸钠制烧碱的化学反应方程式为______。
(3)同学们在探究其化学性质实验后,将剩余固体药品集中放在烧杯中。小明为了弄清剩余固体的成份,进行了如下的探究:
(提出猜想)剩余固体是:I.Na2CO3;Ⅱ.NaHCO3;Ⅲ.______。
(进行实验)
操作 | 现象 | 结论 |
①取少量剩余固体于试管中,加入足量水,充分溶解后,滴加几滴酚酞溶液。 | 溶液由无色变红色。 | 剩余固体一定有: ______ 。 |
②取适量剩余固体于试管中,固定在铁架台上,充分加热。 | 白色固体质量减少, 试管内壁有较多水珠出现。 |
(结论分析)
①据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想______也有相同现象。
②同学们讨论后认为,如要确定剩余固体成分,小明只要做实验操作②,并补充操作______,再通过______即可得出结论。
(拓展反思)
有同学提出,碳酸钙和碳酸氢钙能不能互相转化呢?小明认为可以,因课本“资料卡片”中介绍的《石笋和钟乳石的形成》就是“CaCO3→Ca(HCO3)2→CaCO3”的过程。则“CaCO3→Ca(HCO3)2”化学反应方程式为______。
【答案】Na2CO3 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ Na2CO3和NaHCO3 NaHCO3 Ⅱ 称量加热前后固体的质量 计算 CaCO3+H2O+CO2=Ca(HCO3)2
【解析】
(1)根据质量守恒定律实质:化学反应前后,原子个数不变原则得,反应前,有2Na、2H、2C、6O,反应后现有,2H、1C、3O,故X有2Na、1C、3O,为Na2CO3;
(2)工业上利用碳酸钠和氢氧化钙反应,生成氢氧化钠和碳酸钙,来制取烧碱,化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(3)剩余固体药品可能是碳酸钠,也可能是碳酸氢钠,又或者是两者的混合物,故填写:Na2CO3和NaHCO3;
因为加热剩余固体,白色固体质量减少,试管内壁有较多水珠出现,故剩余固体一定有:NaHCO3;
猜想Ⅱ和猜想Ⅲ中都含有碳酸氢钠,会产生相同的现象,小明的判断不严谨,故填写:Ⅱ;
猜想Ⅱ和猜想Ⅲ中碳酸氢钠的含量不同,故小明只要做实验操作②,并补充操作称量加热前后固体的质量,再通过计算即可得出结论,填写:称量加热前后固体的质量,计算;
根据质量守恒定律实质:化学反应前后,元素种类不变原则得,碳酸钙转化为碳酸氢钙,还需与水和二氧化碳反应,化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2。


科目:初中化学 来源: 题型:
【题目】实验室用10g8%的氢氧化钠溶液和稀硫酸进行中和反应实验,实验过程中溶液的pH变化如图所示:
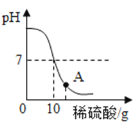
(1)A点溶液的溶质_________。(填化学式)
(2)计算所用的该稀硫酸的质量分数为__________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室现有氯酸钾、二氧化锰、石灰石、 蜡烛、火柴及以下仪器(如图),请回答:
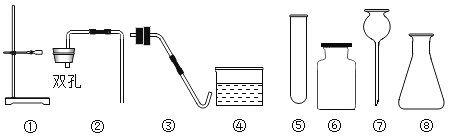
(1)若补充一种常用仪器_____(填名称),利用上述部分仪器和药品可制取并收集一种气体。除补充的仪器外,还应选择的仪器有___(填序号),该反应的化学方程式为_____;
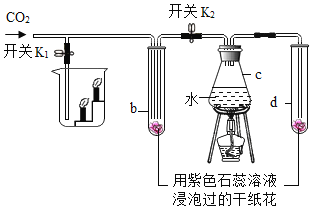
(2)若补充一种药品,还能制取二氧化碳,如图是某同学设计的验证CO2性质的实验装置图。实验时,先关闭K1和K2,加热c,一段时间后再通入CO2,观察到 b、 d 中纸花均不变色。再打开K2,b中纸花逐渐变______,由此证明了CO2能与水反应。若打开 K1,还可以证明CO2 具有的化学性质是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像分别与选项中的操作项对应,其中不合理的是
A.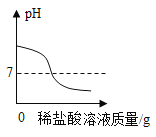 往一定量的NaOH溶液中滴加稀盐酸至过量
往一定量的NaOH溶液中滴加稀盐酸至过量
B.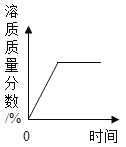 某温度下,将KNO3固体不断地加入水中
某温度下,将KNO3固体不断地加入水中
C. 向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液
向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液
D.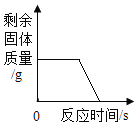 持续不断地加热一定质量的高锰酸钾固体
持续不断地加热一定质量的高锰酸钾固体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组活动中,甲、乙、丙三位同学对某化工厂的污水取样后进行了相关实验,请回答下列问题。
I.用pH试纸检测污水的酸碱性。三位同学分别进行如下实验:
甲同学:取pH试纸于表面皿上,用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7.
乙同学:取pH试纸于表面皿上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7。
丙同学:取pH试纸直接浸入待测液中,测得pH <7.
(1)以上三位同学中操作规范的是___________同学。
Ⅱ.利用中和反应原理测定污水中污染物(设为盐酸)的质量分数。甲、乙两同学设计的方案分别如图甲、图乙所示:
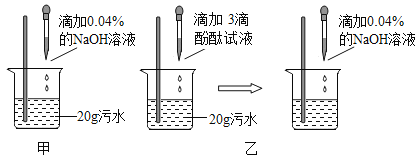
(2)甲同学取少量图甲所示反应后的溶液于试管中,滴加3滴紫色石蕊试液,溶液呈蓝色,于是得出了“两种物质已恰好中和”的结论,甲同学的结论是否正确?_____________ (选填“正确”或“不正确”),理由是______________。
(3)乙同学按图乙方案进行实验,实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且用玻璃棒不断搅拌。当观察到____________现象时, 停止滴加NaOH溶液,此时可认为酸碱恰好完全反应。
(4)若要除去污水中的盐酸,从环保、原材料成本等角度考虑,最好选用________________。
A NaOH
B Ca(OH)2
C Fe2O3
D CaCO3
(5)若图乙方案实验中共消耗了NaOH溶液20g,请计算:
①20g NaOH溶液中溶质质量=______________g.
②污水中HCl的质量分数是多少? ____ (列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取气体所需装置如下图所示。请回答以下问题:

(1)装置中标“a”的仪器名称是_______________;
(2)若用装置 A 制取氧气,则该反应的化学方程式为_____________;
(3)实验室制取二氧化碳时,所选用的发生装置和收集装置的组合是______________(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
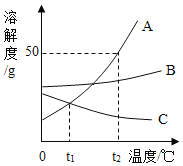
(1)t2℃,A、B、C三种物质的溶解度由大到小的顺序为_____。
(2)_____(填“t1℃”或“t2℃”)时,A、C两物质的溶解度相等。
(3)t2℃,将30克A物质投入50克水中充分溶解,所得溶液的质量为_____克。
(4)t2℃,将A、B、C三种饱和溶液分别降温到t1℃,此时A、B、C三种溶液的溶质质量分数由大到小的顺序为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁是初中化学学习中学过的物质,回答问题。
(1)甲是生命活动中最重要的气体单质能供给呼吸,甲是_____(写化学式)。
(2)乙是化合物既可以作气体燃料,又可以用来冶炼金属铁。乙的化学式是_____;乙与氧化铁反应的化学方程式是_____。
(3)丙可以由丁与水在常温下反应制得,丙常用来改良酸性土壤,丁的化学式为_____。
(4)下列有关丙和丁叙述正确的是_____(填字母序号)。
A 丁与水的反应属于化合反应
B 丙的溶液易吸收空气中的水分而变质,所以需密封保存
C 向滴有酚酞试液的丙的溶液中加入一定量的稀盐酸,溶液最终为无色,则所得溶液中的溶质一定只有一种
D 将少量丁加到丙的饱和溶液中,溶液变浑浊(恢复到原温度),反应后溶液中溶质和溶剂的质量一定减小,溶质的质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E均为初中化学常见的物质,它们的转化关系如图所示,部分生成物及反应条件已略去.

(1)如果A、B均为黑色固体,C是造成温室效应的主要气体,则E的化学式是 ,A与B反应的化学方程式可能是 .
(2)如果C是一种浅绿色溶液,D是红色固体单质,则E的化学式是 ,A与B反应的化学方程式可能是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com