
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
| A. | X Mn Y Ni Z | B. | Z Ni Y Mn X | ||
| C. | Z Mn Y Ni X | D. | X Mn Ni Y Z |
分析 在金属活动性顺序中,只有氢前的金属才可以和稀酸溶液反应生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,根据这一规律可以根据反应的发生来判断金属的活动性强弱.
解答 解:由题意可知,金属Ni只能和Z盐溶液反应,说明Ni的金属活动性比Z强,但比X、Y都弱;金属Mn不能和X盐溶液反应,能够和Y盐溶液和Z盐溶液反应,说明锰的金属活动性比X弱,但是比Y、Z都强,即这几种金属的活动性由强到弱的顺序是X>Mn>Y>Ni>Z.由以上分析可知,A正确,B、C、D错误.
故选A.
点评 本题难度不是很大,主要考查了根据反应的发生来判断金属的活动性顺序,从而培养学生对金属活动性顺序的灵活应用.


科目:初中化学 来源: 题型:解答题
| 实 验 | 1 | 2 | 3 | 4 |
| 加入样品质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
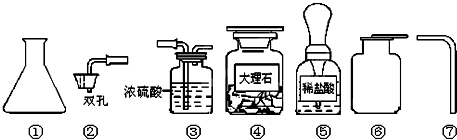
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用带火星的木条 | B. | 分别称取各自的质量 | ||
| C. | 倒入澄清的石灰水 | D. | 用燃着的木条 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
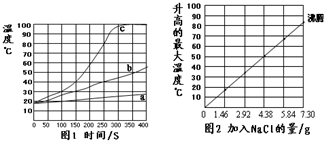 无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).
无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
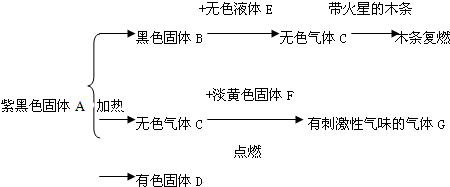
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com