
| ||
| ||
| ||
| ||


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
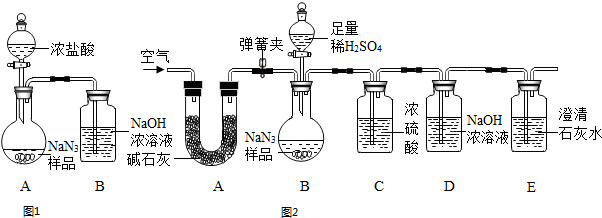
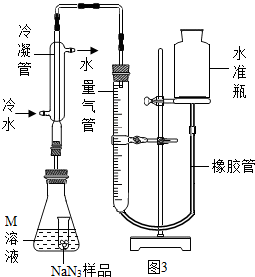
查看答案和解析>>
科目:初中化学 来源: 题型:
 2013年12月2日,“嫦娥三号”探测器由“长征三号乙”运载火箭发射,首次实现月球软着陆和月面巡视勘察.
2013年12月2日,“嫦娥三号”探测器由“长征三号乙”运载火箭发射,首次实现月球软着陆和月面巡视勘察.
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
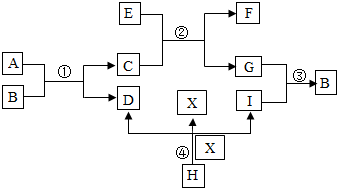 已知A、B、C、D、E、F、G、H、I、X均为初中化学常见的物质.其中E、G为常见金属单质,E是目前世界上产量最高的金属,G呈紫红色,I是地壳中含量最高的元素所形成的常见气体单质;人体胃液中含有A,可帮助消化.根据如图所示的转化关系,回答下列问题.(图中反应条件均已略去,反应物和产物均已给出)
已知A、B、C、D、E、F、G、H、I、X均为初中化学常见的物质.其中E、G为常见金属单质,E是目前世界上产量最高的金属,G呈紫红色,I是地壳中含量最高的元素所形成的常见气体单质;人体胃液中含有A,可帮助消化.根据如图所示的转化关系,回答下列问题.(图中反应条件均已略去,反应物和产物均已给出)查看答案和解析>>
科目:初中化学 来源: 题型:
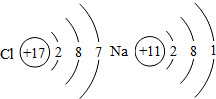 如图是两种元素的原子结构示意图.据此回答:
如图是两种元素的原子结构示意图.据此回答:查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 | -- | 67 | 1 800 |
| 2 | 0.6 | 0.2g 二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | 67 | 89.5 |
| 实验装置 | 实验现象 | 实验分析 |
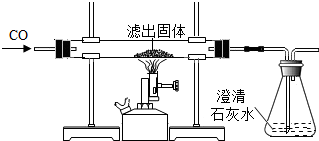 | 玻璃管中红色固体全部变黑 | 生成了铁 |
| 锥形瓶中石灰水变浑浊 | 产生了二氧化碳 |
| 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 | |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO | 不反应 | 反应 | 反应 | 反应 |
| 与稀盐酸 | 反应生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 | |
| 与硫酸铜溶液 | 反应 | 不反应 | 不反应 | 不反应 |
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | 剩余固体中没有氧化亚铁. | |
| 2 | 剩余固体中只有铁粉. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com