解答:解:(1)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X的化学式为:NH
3;氨气的水溶液显碱性,所以检验该气体的方法是:使湿润的红色石蕊试纸变蓝;
(2)生成NaN
2的同时有NaOH生成,氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:2NaOH+CO
2═Na
2CO
3+H
2O;
(3)要测定某工业级NaN
3样品中含有Na
2CO
3的质量分数,根据NaN
3遇盐酸、H
2SO
4溶液无气体生成,而Na
2CO
3遇盐酸、H
2SO
4溶液生成CO
2气体,由CO
2的质量可以求出Na
2CO
3的质量,进而求出Na
2CO
3的质量分数;
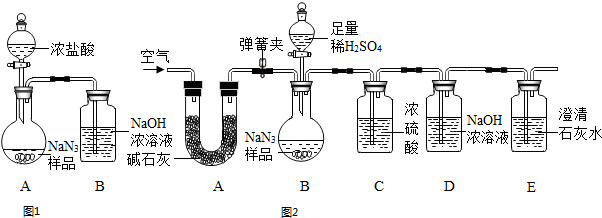
①装置I用浓盐酸与样品反应,浓硫酸具有挥发性,产生的氯化氢气体被装置B吸收,二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收,装置A、B内空气中的二氧化碳被装置B吸收,A中生成的二氧化碳不能全部进入B装置,使实验产生误差等,所以理由可能是:浓盐酸有挥发性,挥发出的氯化氢气体会被氢氧化钠溶液吸收,带来实验误差;
②装置II中A中药品是碱石灰,碱石灰可作干燥剂,能吸收空气中的水分和二氧化碳,防止空气中水蒸汽和二氧化碳干扰试验,C装置的浓硫酸干燥CO
2气体,若无C装置会使实验结果偏大,CO
2通入澄清石灰水,使澄清石灰水变浑浊,装置E的作用是检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳和水蒸气进入D装置,所以图2中A的作用是:除去空气中的水和二氧化碳,若无装置C,对测定结果造成的影响是偏大,装置E的作用是:证明生成的二氧化碳在B中已全部吸收;
③碳酸钠和硝酸钡会生成白色的碳酸钡沉淀,所以判断滴加的试剂已过量的方法是:继续滴加Ba(NO
3)
2溶液,无白色沉淀生成;
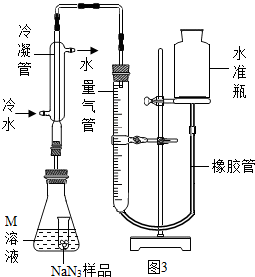
(4)通过分析题中的反应装置可以看出,使小试管中的NaN3样品与M溶液接触的操作是:倾斜锥形瓶,使样品与M溶液接触;
(5)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气,反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是:调节两边液面平衡;
(6)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒,故选:A;
(7)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN
3样品的纯度x
2NaN
32Na+3N
2↑.
130 84
x?0.140g 0.084g
=
解得:X=92.9%
答:NaN
3样品的纯度92.9%.
故答案为:(1)NH
3,使湿润的红色石蕊试纸变蓝;
(2)2NaOH+CO
2═Na
2CO
3+H
2O;
(3)①浓盐酸有挥发性,挥发出的氯化氢气体会被氢氧化钠溶液吸收,带来实验误差;
②除去空气中的水和二氧化碳,偏大,证明生成的二氧化碳在B中已全部吸收;
③继续滴加Ba(NO
3)
2溶液,无白色沉淀生成
(4)倾斜锥形瓶,使样品与M溶液接触;
(5)使水蒸气液化,调节两边液面平衡;
(6)A;
(7)92.9%.



 阅读快车系列答案
阅读快车系列答案 化学反应的基本类型包括:①化合反应,②分解反应,③置换反应,④复分解反应.如图“各路”反应一定不包含的反应类型是( )
化学反应的基本类型包括:①化合反应,②分解反应,③置换反应,④复分解反应.如图“各路”反应一定不包含的反应类型是( ) 如图是某同学设计的实验室制取气体的装置图,请完成下列问题:
如图是某同学设计的实验室制取气体的装置图,请完成下列问题: