
| A. | 消耗的氯化氢一样多 | B. | 碳酸镁消耗的氯化氢少 | ||
| C. | 生成的二氧化碳一样多 | D. | 碳酸氢钠生成的二氧化碳少 |
分析 碳酸镁和碳酸氢钠的化学式分别是MgCO3、NaHCO3,可以看出:镁的相对原子质量为24,NaH的相对原子质量之和为23+1=24,据此进行分析判断.
解答 解:碳酸镁和碳酸氢钠的化学式分别是MgCO3、NaHCO3,镁的相对原子质量为24,NaH的相对原子质量之和为23+1=24,即碳酸镁和碳酸氢钠的相对分子质量相等;相同质量的碳酸镁和碳酸氢钠中含有的CO3一样多.
A、碳酸镁与碳酸氢钠与稀盐酸反应的化学方程式分别是MgCO3+2HCl=MgCl2+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,则相同质量的碳酸镁和碳酸氢钠分别与足量的盐酸反应,碳酸镁消耗的稀盐酸的质量多,故选项说法错误.
B、由A选项的分析,碳酸镁消耗的稀盐酸的质量多,故选项说法错误.
C、由上述分析,相同质量的碳酸镁和碳酸氢钠中含有的CO3一样多,由质量守恒定律,生成的二氧化碳一样多,故选项说法正确.
D、由C选项的分析,生成的二氧化碳一样多,故选项说法错误.
故选:C.
点评 本题难度不大,由化学式确定NaH的相对原子质量之和与镁的相对原子质量相等是正确解答本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碱类物质一定能使酚酞试液变红 | |
| B. | 有盐和水生成的反应一定是中和反应 | |
| C. | 酸雨就是指pH<5.6的雨水 | |
| D. | pH=0的溶液既不显酸性,也不显碱性,呈中性 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
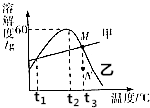 如图是甲、乙两种化合物的溶解度曲线示意图,据此得到的结论正确的是C.
如图是甲、乙两种化合物的溶解度曲线示意图,据此得到的结论正确的是C.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
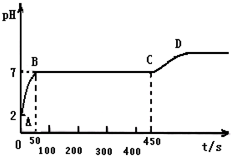 块状石灰石和适量稀盐酸反应至气泡不再逸出后,测得其残留液pH 等于2.此时取反应后澄清溶液10g,逐滴匀速滴入10.6%的碳酸钠溶液,若1秒滴入0.1g碳酸钠溶液,用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:
块状石灰石和适量稀盐酸反应至气泡不再逸出后,测得其残留液pH 等于2.此时取反应后澄清溶液10g,逐滴匀速滴入10.6%的碳酸钠溶液,若1秒滴入0.1g碳酸钠溶液,用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图为某医用葡萄糖注射液的一部分,请你回答下列问题:
如图为某医用葡萄糖注射液的一部分,请你回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积/mL | 80.0 | 54.5 | 126.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com