
| 实验次数 | 1 | 2 | 3 |
| 稀盐酸质量(g) | 50 | 50 | 100 |
| 样品质量(g) | 20 | 30 | 20 |
| 剩余物质质量(g) | 63.4 | 73.4 | 113.4 |
| 产生气体的质量(g) | 6.6 | 6.6 |
分析 (1)根据质量守恒定律,判断第3次实验所得到气体的质量;
(2)对三组实验数据进行分析,通过对比稀盐酸质量、样品质量、产生气体的质量三者间的关系,判断反应进度及反应物剩余情况;
(3)利用第1或3组碳酸钙完全反应所得实验数据,根据反应的化学方程式,由产生二氧化碳质量计算样品中所含碳酸钙质量,求出该石灰石样品的纯度.
解答 解:(1)根据质量守恒定律,第3次实验所得到气体的质量=100g+20g-113.4g=6.6g;故填:6.6;
(2)对比实验1、2,当样品质量增加时,放出二氧化碳质量并未增加,说明实验中稀盐酸已完全反应;对比实验1、3,当稀盐酸质量增加时,放出二氧化碳的质量不变,说明实验中碳酸钙已完全反应;综上所述,20g样品能恰好和50g盐酸反应;故填:1、2;
(3)设20g样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 6.6g
$\frac{100}{x}=\frac{44}{6.6g}$
x=15g
则该石灰石样品的纯度为$\frac{15g}{20g}$×100%=75%
答:该石灰石样品的纯度为75%.
点评 石灰石的主要成分为碳酸钙,因此石灰石样品的纯度即主要成分碳酸钙在样品中的质量分数,即样品中所含碳酸钙质量与样品的质量比.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源: 题型:选择题
| A. | 燃烧需要可燃物接触氧气,所以可燃物接触氧气就一定能燃烧 | |
| B. | 用洗洁剂洗去油污是利用了乳化作用,用汽油洗去油污也是利用了乳化作用 | |
| C. | 溶液具有均一、稳定的特征,所以均一、稳定的液体一定是溶液 | |
| D. | 铁与稀硫酸反应后溶液质量增大,锌与稀硫酸反应后溶液质量也增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 a、b、c三种固体物质的溶解度曲线如图所示,请回答:
a、b、c三种固体物质的溶解度曲线如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁粉 | B. | 纯碱 | C. | 氢氧化钠固体 | D. | 粗盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
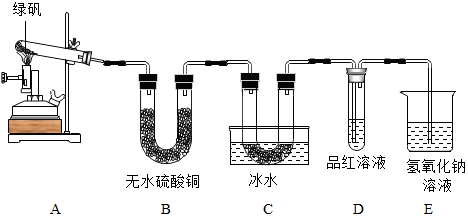


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在空气中燃烧,发出蓝紫色火焰,产生有刺激性气味的气体 | |
| B. | 铁丝在氧气中燃烧,火星四射,放出热量,生成黑色固体 | |
| C. | 红磷在空气中燃烧产生大量的白雾 | |
| D. | 蜡烛在氧气中燃烧产生大量的白烟 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
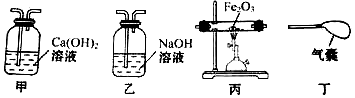
| A. | 甲→乙→甲→丙→甲→丁 | B. | 甲→丙→乙→甲→丁 | ||
| C. | 甲→乙→丙→乙→丁 | D. | 乙→甲→丙→甲→乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com