
【题目】有A、B、C、D四种物质,A是无色、无味的气体;B在A中燃烧发出明亮的蓝紫色火焰,同时生成一种无色、有刺激性气味的气体C;D是一种无色气体,把D通入澄清石灰水中,石灰水变浑浊。试推断A为 ,B为 ,C为 ,D为 。
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:初中化学 来源: 题型:
【题目】下列对化合反应的叙述中,正确的是
A.化合反应一定是氧化反应
B.有氧气参加的反应一定是化合反应
C.必须有氧气参加且只能生成一种物质的反应才是化合反应
D.由两种或两种以上的物质生成另一种物质的反应叫化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列选项中物质的名称、俗称、化学式一致的是
A. 碳酸钠 小苏打Na2CO3 B. 氢氧化钠 纯碱 NaOH
C. 乙醇 酒精CH3 OH D. 氢氧化钙 消石灰Ca(OH)2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙是初中化学常见的三种物质,在一定条件下它们之间的转换关系如图所示(部分物质及反应条件均已略去),其中甲、乙是组成元素相同的两种气体,且丙是常用的建筑材料.请回答:
![]()
(1)甲的一种用途是_________
(2)写出乙转化成丙的化学方程式_________
(3)甲和乙的化学性质不同,写出一点_________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组按右图所示装置制取二氧化碳,并检验二氧化碳的性质:若用装置B来证明二氧化碳与水反应生成碳酸,B中除有少量水外,还应加入的试剂是,当①、②导管口连接时,B中看到的实验现象是:________,其反应的化学方程式为:________。
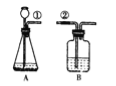
当导管断开一段时间后,看到B中的现象是________,其反应的化学方程式为________.
为测定当地石灰石含碳酸钙的质量分数,该课外活动小组取来一些矿石,并取稀盐酸200g,将其平均分成4份,进行实验,其结果如下:
实验 | 第1份 | 第2份 | 第3份 | 第4份 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
依据表中数据请分析计算:
(1)哪几项反应中盐酸有剩余。
(2)上表中m的数值是。
(3)试计算这种石灰石中碳酸钙的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于氧气的说法不科学的是
A.常用带火星的木条来检验空气中的氧气
B.氧气可以支持燃烧
C.加热氯酸钾制氧气,可用二氧化锰作催化剂
D.氧气可用于医疗急救
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请阅读下面的文章,并据此回答问题:
科学家在研究大气中CO2的浓度变化会对地球的平均气温造成什么影响的问题时,采用的研究途径之一是:研究古气候大气中CO2的浓度变化和当时大气平均温度的变化关系.
(1)有种方法是测量浅海贝类化石中硼、钙元素含量的比例.因为这个比例高低和这些贝类生长时的海水酸碱度有关,而海水酸碱度又和大气中CO2的浓度有关.将得到的有关数据和通过其它研究途径得到的同时期大气平均温度对比,即可得到同时期大气平均温度与大气中CO2的浓度的对应关系.海水酸碱度和大气中CO2的浓度有关的科学原理是______.
请在下列坐标图中,标出坐标轴的含义,并大致表示大气中CO2的浓度对海水酸碱度(用海水pH表示,海水略呈弱碱性)的影响关系.
(2)科学家也通过另外途径研究古气候时CO2的浓度变化与当时大气平均温度的关系.
如比较古代植物叶片化石及近现代植物标本,发现很多地区较多同种近现代植物叶片单位面积上气孔数目减少.从植物对环境的适应性考虑,造成这种变化的可能原因是:______、______(请写出两种).
(3)在生物圈中,你认为当前影响大气中CO2浓度变化的主要直接因素是:______、______(请写出两点).
查看答案和解析>>
科目:初中化学 来源: 题型:
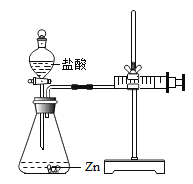
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com