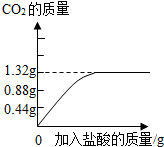
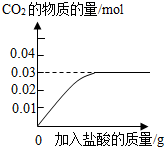
为了测定石灰石中含CaCO3 的质量分数,取石灰石12.5g 加入盛有100g 稀盐酸的烧杯中,两者恰好完全反应(假设杂质不和盐酸反应,也不溶解),烧杯内物质的质量变为108.1g.
(1)反应的化学方程式为______.
(2)生成二氧化碳气体______g.(提示:可根据质量守恒定律求出)
(3)12.5g石灰石含CaCO3______g,石灰石中CaCO3 的质量分数为______.
(4)100g 稀盐酸中溶质是______,其质量是______g;溶剂是______,其质量是______g.
(5)完全反应后烧杯内还有不溶杂质,烧杯内所得溶液的名称为______,所得溶液的质量为______g,其中溶质的质量为______g,溶剂的质量为______g.
解:(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;
(2)根据质量守恒定律,生成二氧化碳的质量=12.5g+100g-108.1g=4.4g
(3)设反应消耗碳酸钙的质量为x,消耗HCl的质量为y,生成氯化钙的质量为z
CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O
100 73 111 44
x y z 4.4g
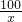
=
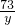
=
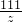
=
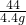
x=10g,y=7.3g,z=11.1g
石灰石中CaCO
3 的质量分数=

×100%=80%
(4)稀盐酸即HCl溶液,其溶质为HCl,其质量为7.3g;溶剂为水,其质量=100g-7.3g=92.7g;
(5)由于杂质不和盐酸反应也不溶解,恰好完全反应后所得溶液为氯化钙溶液,根据质量守恒定律,该溶液的质量=108.1g-(12.5g-10g)=105.6g,其中溶质氯化钙的质量为11.1g,溶剂的质量为105.6g-11.1g=94.5g.
故答案为:
(1)CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O
(2)4.4
(3)10,80%
(4)氯化氢或HCl,7.3,水或H
2O,92.7
(5)氯化钙(的水)溶液,105.6,11.1,94.5
分析:石灰石的主要成分碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,反应前后的质量差即反应放出二氧化碳的质量,由该质量利用反应的化学方程式可计算参加反应碳酸钙的质量、HCl的质量及生成氯化钙的质量,当两者恰好完全反应时,反应后的溶液为氯化钙溶液,利用质量守恒定律,可计算该溶液的质量,再利用溶液由溶质、溶剂两部分组成,判断稀盐酸、氯化钙溶液中溶质、溶剂的质量.
点评:利用好质量守恒定律,可求出反应生成二氧化碳的质量及反应后所得氯化钙溶液的质量,体现出分析问题与解决问题的能力.

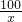 =
=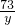 =
=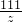 =
=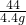
 ×100%=80%
×100%=80%

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案

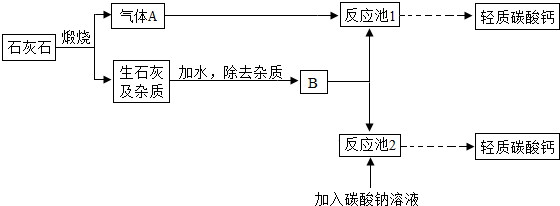
 (2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知: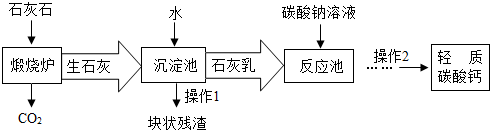

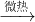 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O

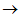 Ca(HCO3)2;Ca(HCO3)2
Ca(HCO3)2;Ca(HCO3)2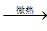
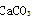 ↓+CO2↑+H2O
↓+CO2↑+H2O