
 如图表示某些物质间转化关系.A、B为组成元素相同的无色液体,D是大理石的主要成分,C、F、H为气体,且H有刺激性气味.
如图表示某些物质间转化关系.A、B为组成元素相同的无色液体,D是大理石的主要成分,C、F、H为气体,且H有刺激性气味.分析 根据D是大理石的主要成分,所以D是碳酸钙,A、B为组成元素相同的无色液体,C、F、H为气体,A和二氧化锰反应会生成B、C,所以A是过氧化氢溶液,B是水,C是氧气,碳酸钙高温会生成氧化钙和二氧化碳,水和E生成的G会与氯化铵反应,所以E是氧化钙,G是氢氧化钙,F就是二氧化碳,氯化铵和氢氧化钙反应生成氨气,所以H是氨气,然后将推出的物质进行验证即可.
解答 解:(1)D是大理石的主要成分,所以D是碳酸钙,A、B为组成元素相同的无色液体,C、F、H为气体,A和二氧化锰反应会生成B、C,所以A是过氧化氢溶液,B是水,C是氧气,碳酸钙高温会生成氧化钙和二氧化碳,水和E生成的G会与氯化铵反应,所以E是氧化钙,G是氢氧化钙,F就是二氧化碳,氯化铵和氢氧化钙反应生成氨气,所以H是氨气,经过验证,推导正确,所以E是CaO;
(2)反应③是碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,二氧化锰是该反应的催化剂,起催化作用;
(3)反应②是氢氧化钙和氯化铵在加热的条件下反应生成氯化钙、水和氨气,化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,由此反应可知,在农业生产中施用铵态氮肥时应注意:铵态氮肥不能与碱性物质混合使用;
(4)通过推导可知,F是二氧化碳,C是氧气,自然界中普遍存在着二氧化碳转化为氧气的反应是光合作用,二氧化碳和氨气在一定条件下反应生成尿素和水,化学方程式为:CO2﹢2NH3$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2﹢H2O,反应中F和H的质量比为:22:17.
故答案为:(1)CaO;
(2)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,催化作用;
(3)不能与碱性物质混合使用;
(4)光合作用,22:17.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 配制好浓度为6%的NaCl溶液装瓶时不小心撒漏一部分,剩余溶液浓度仍为6% | |
| B. | 长期放置后不会分层的液体一定是溶液 | |
| C. | KNO3饱和溶液一定比不饱和溶液溶质质量分数大 | |
| D. | 降低饱和溶液的温度,一定有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
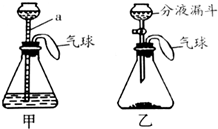 某化学兴趣小组设计了一组“吹气球”实验,两套装置如图所示:
某化学兴趣小组设计了一组“吹气球”实验,两套装置如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:推断题
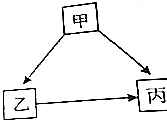 甲、乙、丙皆为初中化学常见物质,有如图所示的转化关系(“→”表示转化关系其它物质和反应条件已略去).
甲、乙、丙皆为初中化学常见物质,有如图所示的转化关系(“→”表示转化关系其它物质和反应条件已略去).查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
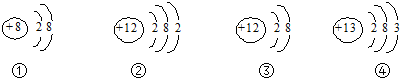
| A. | ①图是一种稀有气体元素的原子结构示意图 | |
| B. | ②图所示的粒子是一种离子 | |
| C. | ②③图所示的粒子化学性质相似 | |
| D. | ③④两图表示的是两种不同元素的微粒 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 唾液 6.6-7.1 | B. | 胃液 0.9-1.5 | C. | 汗液 6.6-7.6 | D. | 血浆 7.35-7.45 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某兴趣小组利用如图所示装置测定石灰石样品中碳酸钙的质量分数,探究过程如下(注:石灰石样品中的杂质不参与反应也不溶解);
某兴趣小组利用如图所示装置测定石灰石样品中碳酸钙的质量分数,探究过程如下(注:石灰石样品中的杂质不参与反应也不溶解);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com